PLSCR1是对抗新冠病毒感染的重要细胞防御因子
细胞自主免疫(Cell-autonomous immunity)是单个细胞内部发生的固有免疫反应,以限制入侵细胞内的病原体比如细菌,病毒,寄生虫等的复制与传播。在人体中,高度特化的免疫系统与免疫细胞是机体应对微生物感染的重要手段。除此之外,越来越多的证据表明,细胞自主免疫机制在其他非免疫细胞(如数量巨大又处在接触微生物病原体第一线的上皮细胞,成纤维细胞等)中的激活对于机体的整体防御同样不可或缺。干扰素(Interferon, IFN)反应是细胞自主免疫机制的重要组成部分。及时有效的干扰素反应在机体应对新冠病毒SARS-CoV-2感染时非常重要。干扰素信号通路的先天性缺陷或是血液中抗干扰素抗体的存在将导致更为严重的新冠病毒感染症状【1,2】。干扰素通过诱导细胞内数百种干扰素诱导基因(Interferon-stimulating genes, ISG)的表达来武装细胞对抗病原体感染。然而迄今为止,人们对这些非经典的免疫武器所涉及的分子机制仍不甚了解。
2023年7月12日,美国耶鲁大学医学院的John D. MacMicking团队(徐迪进博士以及Weiqian Jiang博士是本文共同第一作者)在Nature杂志上发表了一篇题为PLSCR1 is a cell-autonomous defense factor against SARS-CoV-2 infection的文章。这项研究在 IFN-γ激活的人类上皮细胞中进行了全基因组 CRISPR/Cas9 筛选,鉴定出磷脂翻转酶1(Phospholipid scramblase 1, PLSCR1)能够显著抑制新冠病毒与宿主细胞的融合,从而保护多种非免疫细胞类型免受感染。
作者使用Huh7.5细胞以及A549-ACE2细胞作为感染模型。通过全基因组CRISPR/Cas9筛选发现,在测试的两种细胞中,PLSCR1都是排名最高的候选基因之一。PLSCR1在以往的研究中被报道能够抑制或者促进病毒复制【3,4】,然而其在新冠病毒感染中的作用还是未知。作者进一步通过CRISPR敲除细胞中的PLSCR1,发现在静息状态下,其缺失就能导致新冠病毒感染显著上升,而干扰素介导的抗病毒效用也大打折扣。PLSCR1 cDNA的补充则可以修复这一缺陷。基因表达分析发现PLSCR1广泛的表达于多种上皮细胞中,并且其表达水平能够进一步被新冠病毒感染以及干扰素刺激上调。由此可见,PLSCR1作为一种干扰素刺激基因能够同时在静息或者干扰素反应启动时,有效控制非免疫细胞中新冠病毒的感染。
进一步的分析发现,除了针对野生型新冠病毒,PLSCR1对新冠德尔塔(Delta)和奥密克戎(Omicron)毒株的感染同样具有抑制作用。鉴于本世纪以来,三种能够导致重症的冠状病毒(SARS-CoV, MERS-CoV以及SARS-CoV-2)都极有可能由天然动物宿主(如蝙蝠,骆驼等)传播而来。作者接下来调查PLSCR1同源蛋白是否在动物宿主中也具有进化保守的抗病毒功能。结果显示蝙蝠以及实验动物小鼠的PLSCR1同源蛋白也同样具有相似的抗病毒活性。进一步分析还发现PLSCR1的抗病毒功能广泛的存在于多种人体上皮细胞系以及原代支气管上皮细胞中。综上,PLSCR1的抗冠状病毒功能的进化保守性和普遍性从另一个侧面证明了其功能在机体免疫对抗新冠病毒中的重要性。
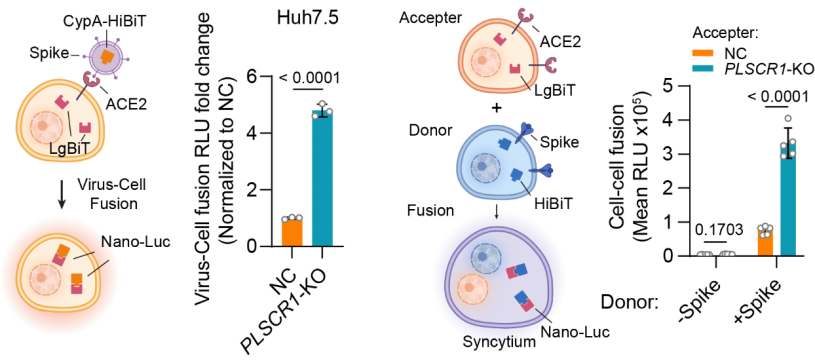
新冠病毒在结合细胞表面ACE2受体之后,可以通过内吞途径或者蛋白酶TMPRSS2介导的细胞表面融合途径入侵细胞。为了阐述PLSCR1是在哪个步骤抑制新冠病毒的入侵,作者使用一系列病毒学以及细胞生物学手段对冠状病毒入侵细胞的过程进行逐步分析。结果显示PLSCR1并不影响ACE2受体的表达,不影响新冠病毒与ACE2的结合以及紧接着的内吞过程,不影响内吞体的酸化以及Spike蛋白的切割,而是特异性的抑制病毒与内吞体膜或是细胞质膜融合的过程,进而抑制新冠病毒RNA释放进入细胞质,从而达到抑制新冠病毒感染的功能。
PLSCR1抑制新冠病毒早期入侵的结论进一步被亚细胞定位分析所支持。共聚焦显微镜,活细胞动态成像以及4Pi-SMS超分辨率显微镜分析显示,PLSCR1能够在病毒入侵细胞之后,快速由静息状态下的细胞质膜重新定位到包含新冠病毒的内吞体表面,而并不与后期形成的病毒复制和转录中心(RTC)共定位。作者进一步揭示PLSCR1的膜定位是由棕榈酰化(Palmitoylation)介导的。棕榈酰化位点的突变将导致其内吞体膜定位以及抗新冠病毒活性的丧失。
为了详细分析PLSCR1抑制新冠病毒的分子机制,作者进一步使用Alphafold2模型以及分子动态模拟(Molecular dynamic simulation)对其进行结构分析。结果显示PLSCR1由N端的无序结构, C端的β-桶(β-barrel)结构域以及埋在β-桶中的疏水螺旋组成。结构域分析显示β-桶以及疏水螺旋是PLSCR1抗病毒活性所必需的。早前报道的全基因组关联性分析(GWAS)发现人群中天然存在的PLSCR1单核苷酸多态性SNP(rs343320; His262Tyr)和重症新冠之间有着显著关联【5】。作者使用多种细胞感染模型证实了与野生型PLSCR1相比,His262Tyr突变体的抗新冠病毒活性显著减弱。这种减弱可以归因于His262Tyr突变体无法有效抑制新冠病毒与宿主细胞的融合。值得注意的是,His262位点同样位于β-桶的外侧亲水面,进一步提示β-桶结构域在抑制新冠病毒感染中的重要作用。分子动态模拟提示His262Tyr突变可能导致其周围氢键网络的改变以及β-桶整体刚性的减弱,从而削弱其抗病毒活性。这部分研究为人群遗传学相关性分析提供了直接的分子生物学证据,同时也进一步证实了PLSCR1在抑制新冠病毒感染方面的重要性。
最后,作者通过调查细胞膜磷脂酰丝氨酸(Phosphatidylserine, PS)翻转活性,进一步证明PLSCR1抑制新冠病毒的功能与其微弱的磷脂翻转酶活性无关。

综上,作者鉴定并详细阐述了PLSCR1抑制新冠病毒感染的全新机制。该研究加深了人们对于细胞自主防御以及干扰素反应如何在非免疫细胞中对抗新冠病毒感染的理解,为将来应对可能再次出现的新病毒大流行提供了新的治疗选择。
原文链接:https://doi.org/10.1038/s41586-023-06322-y
参考文献
1.Zhang, Q., et al. Inborn errors of type I IFN immunity in patients with life-threatening COVID-19. Science 370, eabd4570 (2020).
2.Manry, J., et al. The risk of COVID-19 death is much greater and age-dependent with type I IFN autoantibodies. Proc. Natl Acad. Sci. USA. 119, e2200413119 (2022).
3.Luo, W. et al. Phospholipid scramblase 1 interacts with influenza A virus NP, impairing its nuclear import and thereby suppressing virus replication. PLoS Pathog 14, e1006851 (2018).
4.Cheshenko, N. et al. Herpes simplex viruses activate phospholipid scramblase to redistribute phosphatidylserines and Akt to the outer leaflet of the plasma membrane and promote viral entry. PLoS Pathog 14, e1006766 (2018).
5.Kousathanas, A. et al. Whole genome sequencing reveals host factors underlying critical Covid-19. Nature 607, 97-103 (2022).
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942

