基于壳聚糖接枝铁掺杂碳点的高效人工纳米酶去除细菌生物膜的技术
摘要:细菌生物膜因其对公众健康的严重威胁而引起了全世界的关注,但如何有效地消除细菌生物膜仍然是巨大的挑战。在这里,我们合理地设计了一种新颖而有力的壳聚糖接枝铁掺杂碳点 (壳聚糖@铁/碳点)作为一种有效的人工纳米酶,通过选择性激活芬顿反应(Fenton-like reaction)触发过氧化物酶样催化活性和壳聚糖的协同抗菌来对抗刚性细菌生物膜。一方面,过氧化物酶样催化活性CS@Fe/CD催化过氧化氢产生羟基自由基(•OH),从而有效切割胞外DNA(eDNA)。另一方面,壳聚糖能够通过静电相互作用与带负电荷的细胞膜结合,改变细胞膜的通透性并导致细菌生物膜内的细胞死亡。基于它们的协同作用,细菌生物膜碎片和暴露的细菌被持久地根除。壳聚糖@铁/碳点的纳米酶不仅能够有效地破坏革兰氏阳性金黄色葡萄球菌生物膜,而且能够完全消除革兰氏阴性铜绿假单胞菌生物膜。提出的细菌生物膜清除协同策略可能为食品安全和环境保护中细菌生物膜污染的管理提供一种强有力的模式。
基于壳聚糖@铁/碳点人工纳米酶消除生物膜的原理图
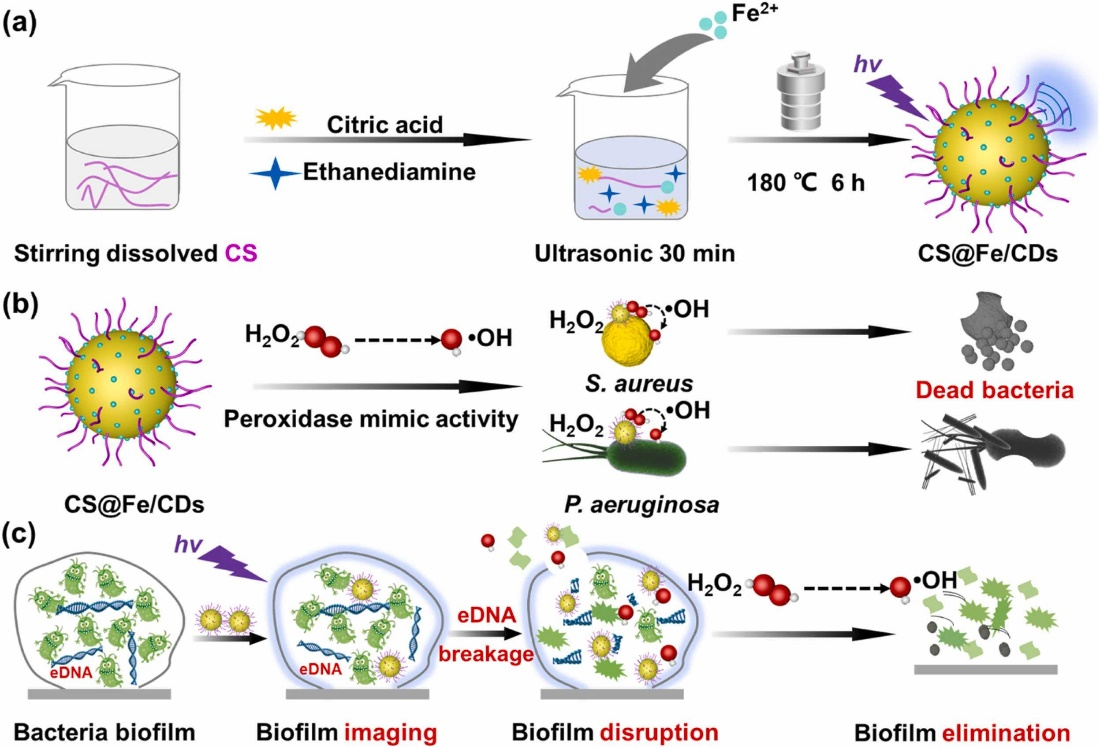
图中为本研究中人工纳米酶的合成途径以及消除金黄色葡萄球菌和铜绿假单胞菌生物膜的技术原理;图(a)为利用一锅水热法合成壳聚糖@铁/碳点纳米酶;图(b)为壳聚糖@铁/碳点纳米酶基于过氧化氢酶活性对抗细菌的示意图;图(c)为壳聚糖@铁/碳点纳米酶消除生物膜的原理图。
基于壳聚糖@铁/碳点的纳米酶的表征
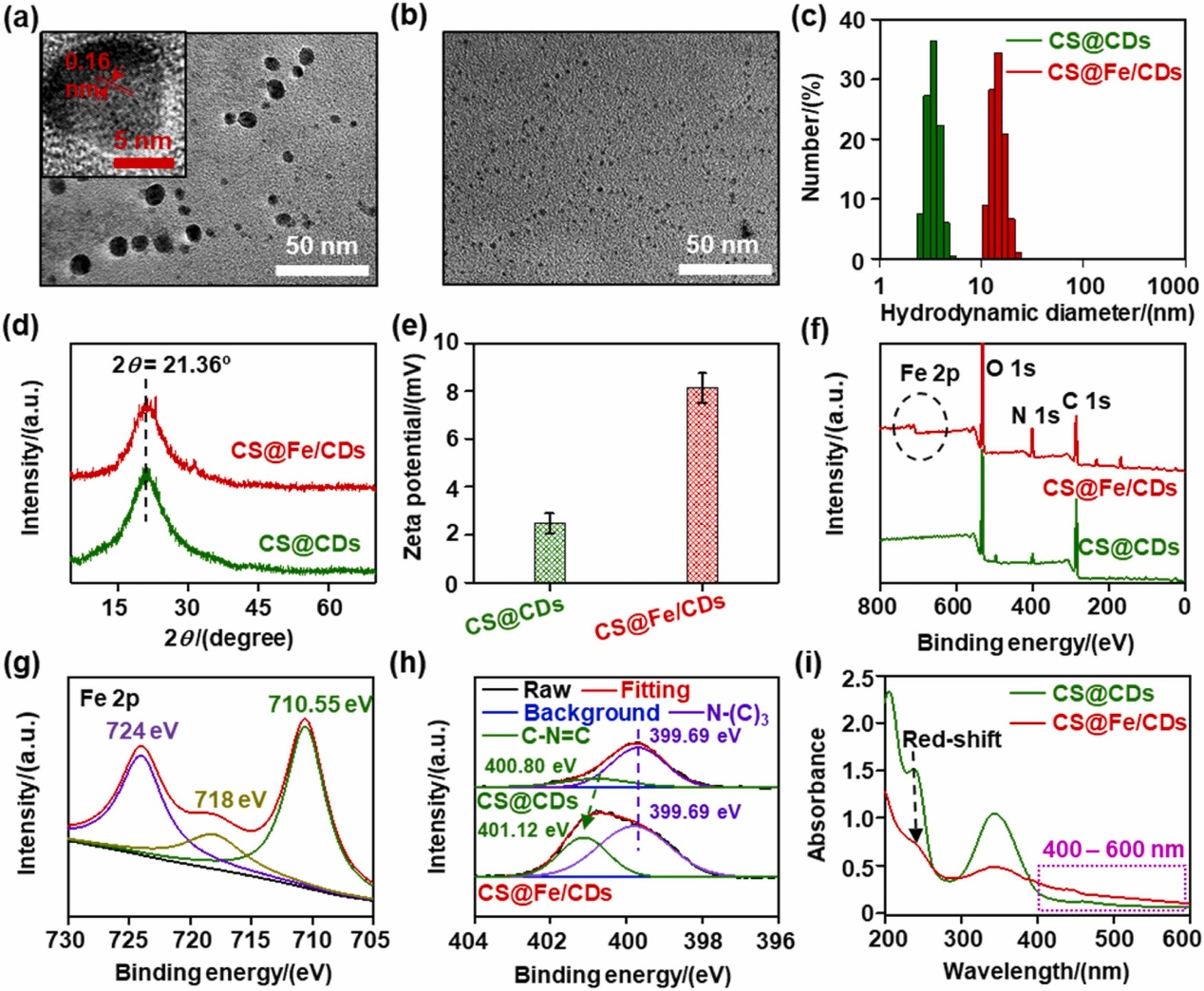
图(a)为壳聚糖@铁/碳点的TEM图像,可以看出,合成的纳米酶具有良好的分散性,且壳聚糖@铁/碳点1.6Å的晶格条纹对应于优良结晶度的(100)的平面间距石墨碳;图(b)为壳聚糖@碳点的TEM,与图(a)相比,尺寸明显更小;图(c)为壳聚糖@碳点和壳聚糖@铁/碳点的水合粒径图,图中表明,壳聚糖@铁/碳点的水合粒径明显的大于壳聚糖@碳点,从而也证明了铁的成功掺杂;图(d)为壳聚糖@铁/碳点和壳聚糖@碳点的X-光衍射峰图,图中可以看出中心位置有一个宽峰2θ = 21.36º,说明壳聚糖@铁/碳点和壳聚糖@碳点都具有丰富的官能团;图(e)为壳聚糖@碳点和壳聚糖@铁/碳点的zate电位,可以看出壳聚糖@铁/碳点的电位比壳聚糖@碳点更高,这也侧面证明了铁的掺杂成功;为了证明这个观点,壳聚糖@铁/碳点和壳聚糖@碳点的XPS全扫描图以及分峰情况如图(f)-(i)所示,图(f)中XPS的全扫描图可以看出,壳聚糖@铁/碳点中包含C、N、O和Fe元素,而壳聚糖@碳点中并不包含Fe元素;图(g)显示Fe2+的峰面积分布要大于Fe3+的峰面积分布,表明Fe2+是壳聚糖@铁/碳点的主要铁元素;图(i)为壳聚糖@碳点和壳聚糖@铁/碳点的N1s图谱,可以看出,壳聚糖@铁/碳点与壳聚糖@碳点相比,在401.12 eV多了一个C-N=C峰谱,由此说明,铁与壳聚糖@碳点主要是通过C-N=C形成壳聚糖@铁/碳点;图(i)为壳聚糖@碳点和壳聚糖@铁/碳点的吸收光谱,壳聚糖@碳点在234 nm的吸收峰红移到了247 nm,这也是因为铁的掺杂导致表面极性的改变和尺寸的增加,此外壳聚糖@铁/碳点在400-600 nm的范围要强于壳聚糖@碳点,也证明了铁与壳聚糖@碳点内部sp2-杂化 N发生螯合作用。
基于壳聚糖交联接枝的表征
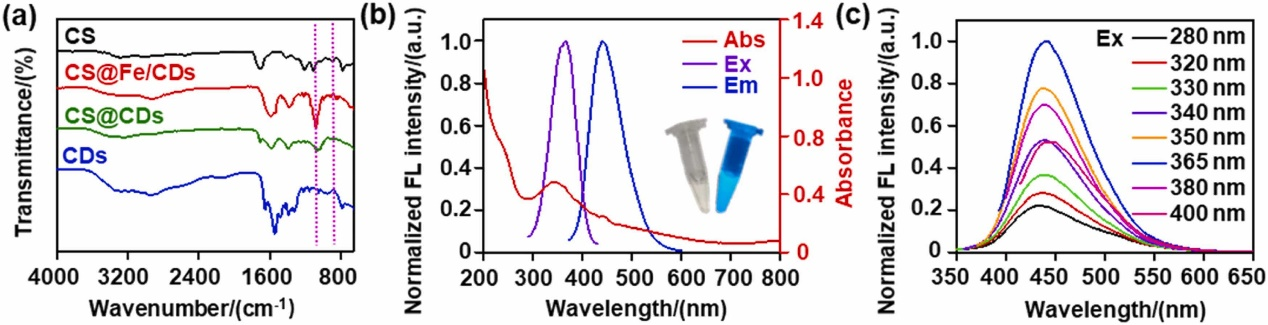
图(a)为壳聚糖,壳聚糖@铁/碳点,壳聚糖@碳点,碳点的傅里叶红外光谱。图中可以看出壳聚糖在897 cm−1处存在β-1,4-糖苷键,C-O-C弯曲和C-N拉伸震动的特征峰存在于1152 cm−1 和 1573 cm−1,这在壳聚糖@铁/碳点和壳聚糖@碳点中也都能够观察到。与壳聚糖相比,壳聚糖@铁/碳点和壳聚糖@碳点在1064 cm−1-1130 cm−1的C-H振动吸收带消失,这是因为壳聚糖链降解及其吡喃环脱水或分解的结果。此外,我们发现壳聚糖@碳点,壳聚糖@铁/碳点在3400 cm−1 和1668 cm−1出现-CONH键,根据这些发现,我们可以确定壳聚糖通过共价酰胺键成功接枝到碳点表面。图(b)为壳聚糖@铁/碳点的吸收光谱,激发光谱和发射光谱,在吸收光谱中247 nm处的特征吸收峰 可能归因于芳香族sp2结构域π→ π * 跃迁,而在365 nm的另一个特征吸收峰是因为掺杂N原子触发表面激发缺陷态和C=O导致n→ π * 过渡;图(c)为不同激发波长下壳聚糖@铁/碳点的发射光谱。图中可以看出,在不同激发波长下,发射波长位置保持不变,这也进一步证明了其富含sp2表面结构。
壳聚糖@铁/碳点催化活性的分析
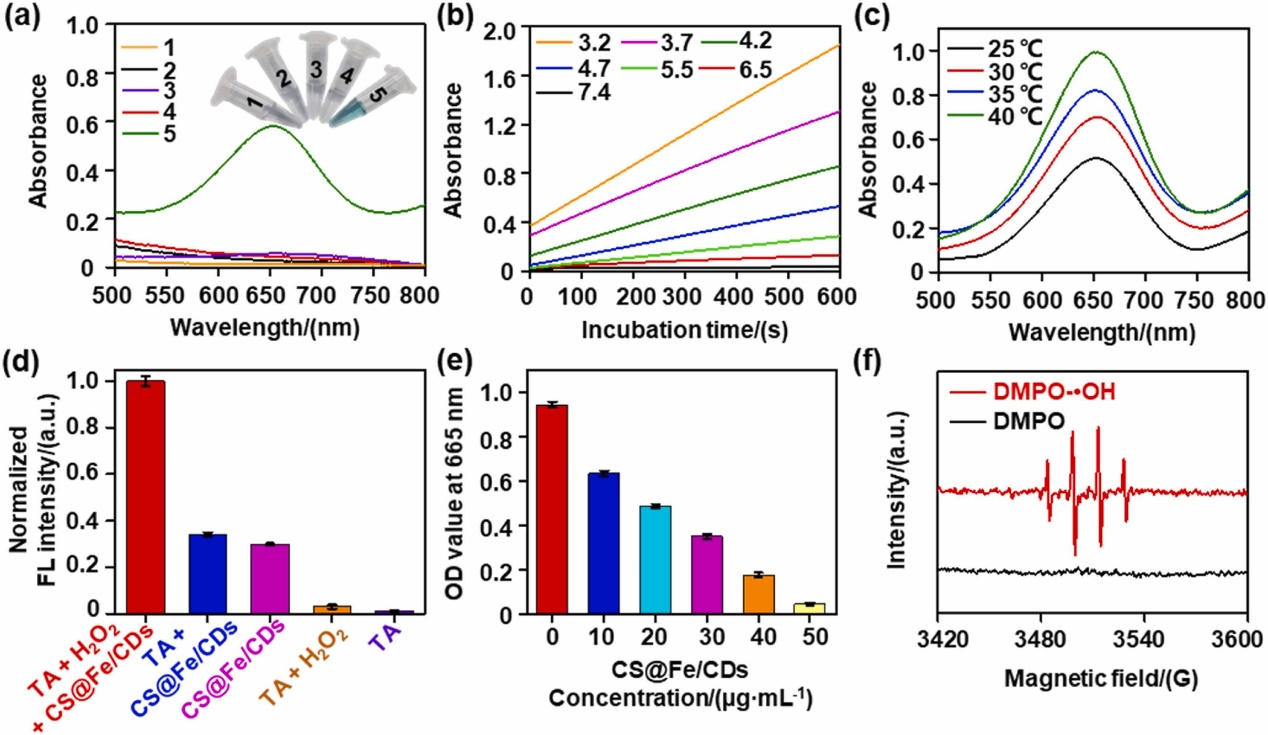
图(a)为不同组分添加过氧化氢和3,3',5,5'-四甲基联苯胺(TMB)后的吸收光谱和显色情况,可以看出,除了壳聚糖@铁/碳点之外,其它组分均产生了可以忽略的吸收强度和蓝色;图(b)为在缓冲液中不同pH条件下不同孵育时间的吸光强度,可以看出壳聚糖@铁/碳点与缓冲液中的pH具有依赖性;图(c)也说明壳聚糖@铁/碳点的催化活性与温度也呈依赖性;图(d)、(e)、(f)分别探究了是否壳聚糖@铁/碳点能够催化过氧化氢产生•OH。图(d)显示,只有体系中同时出现壳聚糖@铁/碳点和过氧化氢,才能在425 nm处产生较强的荧光,这是由于对苯二甲酸能够被•OH氧化成2-羟基对苯二甲酸,在425 nm处产生荧光所导致;图(e)为亚甲基蓝降解比色法鉴定•OH的产生,由于亚甲基蓝降解主要归因于•OH,图中可以看出,随着壳聚糖@铁/碳点浓度增加,体系的吸光度逐渐降低,这意味着•OH的高低决定于壳聚糖@铁/碳点的浓度;最后,图(f)为将5,5-二甲基-1-吡咯烷N-氧化物(DMPO)作为指示剂,当加入壳聚糖@铁/碳点和过氧化氢后,通过电子顺磁共振(EPR)光谱可以观察到四个强度为1:2:2:1的峰。上述实验结果有力地证明了CS@Fe/CD具有出色的过氧化物酶模拟活性,可将过氧化氢催化为有毒的•OH,预示着其具有显著的抗菌前景。
壳聚糖@铁/碳点的抗菌活性的探究
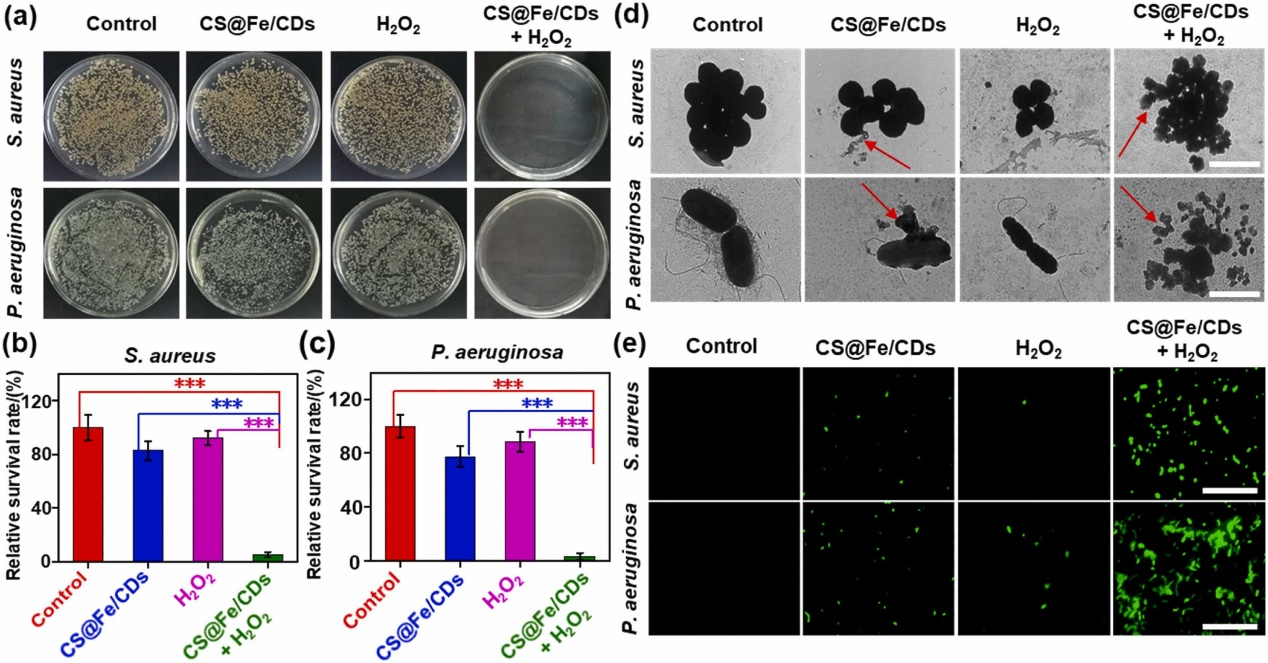
图(a)为四种方式治疗条件下,金黄色葡萄球菌和铜绿假单胞菌的照片,可以看出,当同时加入壳聚糖@铁/碳点后,金黄色葡萄球菌和铜绿假单胞菌几乎全部被杀死;图(b)、(c)为活着的金黄色葡萄球菌和铜绿假单胞菌的相对存活率的定量分析;图(d)为在四种治疗模式下的TEM图像,可以看出,单独加入壳聚糖@碳点会使菌产生轻微的变形,金黄色葡萄球菌的表面出现轻微的破裂,铜绿假单胞菌的表面也不再光滑,这是由于壳聚糖本身的抗菌特性导致的。而当同时加入壳聚糖@铁/碳点和过氧化氢后,TEM下的细胞完全破裂粉碎;为了验证•OH在活菌内也已经产生,采用DCFH-DA作为指示剂,对活金黄色葡萄球菌和铜绿假单胞菌进行•OH荧光成像,图(e)可以看出,壳聚糖@铁/碳点+过氧化氢的组分的绿色荧光要远超其它组分,这强有力的说明该纳米酶可通过外部的壳聚糖搭配内部的有毒•OH协同抗菌,导致细菌显著死亡。
壳聚糖@铁/碳点对细菌生物膜的消除
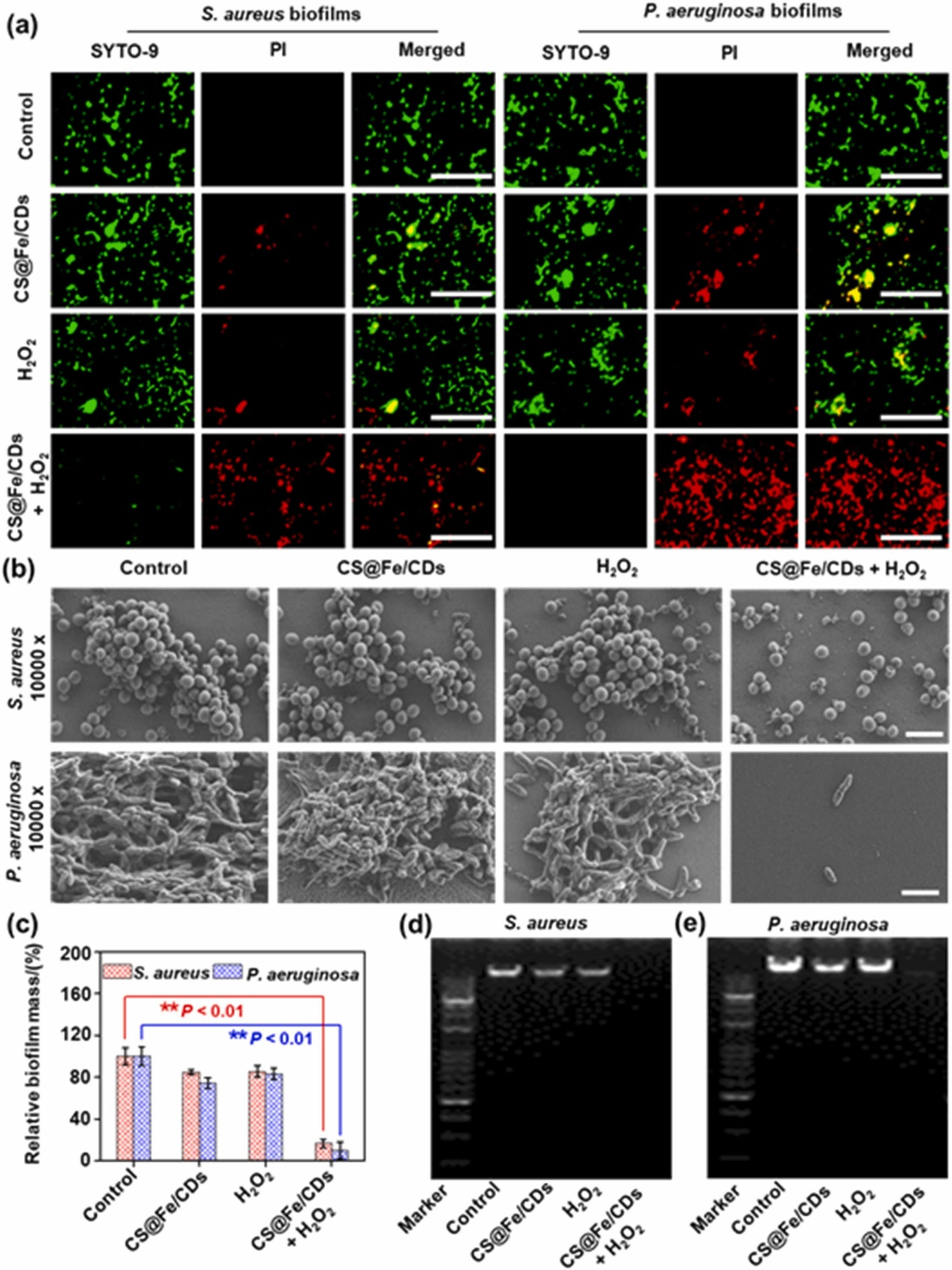
众所周知,SYTO-9可以进入所有细菌细胞结合DNA以发出绿色荧光,而PI只能穿透死亡细菌细胞发出红色荧光,当两种染料都存在于死亡细菌细胞内时,导致SYTO-9的荧光显著降低。图(a)可以看出,加入壳聚糖@铁/碳点的红色荧光明显强于其它组分。这一事实证明,壳聚糖@铁/碳点能够诱导过氧化氢产生•OH,从而破坏细菌生物膜;图(b)的SEM图可以观察到图(a)类似的结果,加入壳聚糖@铁/碳点的组分生物膜明显被破坏,从而导致明显的细菌表面收缩和破裂;如图(c)所示,通过CV染色的定量分析后,超过95.28%的铜绿假单胞菌生物膜生物量被壳聚糖@铁/碳点和过氧化氢清除,而在相同条件下,约83.23%的金黄色葡萄球菌生物膜生物量减少;细菌生物膜的抗性主要来源于由蛋白质、多糖和eDNA组成的特殊EPS。其中,eDNA被视为将细菌和EPS的其他成分组装成完整生物膜的“交联剂”。同时,eDNA与细菌粘附和细菌生物膜的稳定性呈正相关,为了证明本研究中壳聚糖@铁/碳点能够催化过氧氢产生毒•OH从而对eDNA进行切割,用琼脂糖凝胶电泳来进行验证。如图(d)和(f)所示,除了壳聚糖@铁/碳点+过氧化氢组分,其它组分均具有较为明显的条带,因此证明了壳聚糖@铁/碳点是通过催化过氧化氢产生的•OH,从而降解了eDNA,破坏了细菌的生物膜。
结论
1、首次利用一锅水热法成功合成了壳聚糖@铁/碳点纳米酶,其表现出优异的过氧化物酶样活性。
2、实验结果证明,壳聚糖@铁/碳点的过氧化氢酶活性远优于天然HPR酶。
3、壳聚糖@铁/碳点通过催化过氧化氢产生•OH,从而降解eDNA,消除生物膜。
4、该纳米酶在革兰氏阳性菌金黄色葡萄球菌以及革兰氏阴性菌铜绿假单胞菌中均表现出高效的消除能力。
5、本研究中协同抗生物膜能力的壳聚糖@铁/碳点不仅为高效生物膜处理的开发提供了宝贵的信息,而且为广泛研究开发经济和环保的碳基纳米酶以保护食品安全和环境健康提供了新的见解。
参考文献:
Pan, T., Chen, H., Gao, X., et al. (2022). Engineering efficient artificial nanozyme based on chitosan grafted Fe-doped-carbon dots for bacteria biofilm eradication. Journal of Hazardous Materials, 435, 128996.
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942

