集成级联过滤和液滴数字化检测的微流控分析系统实现碳青霉烯类耐药菌的免分离培养表型鉴定
碳青霉烯耐药微生物(Carbapenem-resistant organisms, CRO)具有高耐药性、快速传播、高致死率的特点。CRO的快速检测对抗生素的合理采用和病患的早期隔离至关重要。液滴数字化显色分析(Droplet digital chromogenic assays, DDCA)因其微小的反应体系能够显著提高显色因子的局部浓度继而缩短反应时间,已成为病原快速检测的一大利器。
CRO是对碳青霉烯类抗生素耐药的革兰氏阴性杆菌(G—)的统称,主要包括耐碳青霉烯类大肠杆菌(CREC)、耐碳青霉烯类肺炎克雷伯菌(CRKP)、耐碳青霉烯类鲍曼不动杆菌(CRAB)和耐碳青霉烯类铜绿假单胞菌(CRPA)。CRO感染因其治疗药物选择有限,已被WHO确定为最高风险的感染源。因此,临床上亟需一种实现CRO快速、准确检测的方法,以帮助临床合理选择抗生素和实施病人隔离。目前,临床上检测CRO主要有2种方案:基因型和表型。前者靶向碳青霉烯酶基因序列,避免了耗时的病原分离培养,但这样的方法:1)无法检测未知的序列;2)阴性结果不代表细菌对碳青霉烯类药物敏感(非酶耐药机制);3)阳性结果也不一定表明碳青霉烯类药物的耐药性(基因表达与否)。相比之下,表型分析(监测抗生素处理后细菌的生长情况)结果更值得相信。然而,表型分析通常需要较长的检测周期(1~2天),这可以归因于两方面:1)体液中常含有多种微生物,临床需要对样本进行分离培养获得单菌落才能进行后续的抗生素药敏测试(Antimicrobial susceptibility test, AST);2)现有的AST方法,如微量肉汤稀释和VITEK-2方法,在毫升反应体系中培养,需要长时间积累显色因子才能达到检测限。因此,实现快速CRO识别需要解决两个关键问题:1)病原免分离培养;2)缩短显色时间。DDCA是一个快速AST方案,通过将细菌和AST反应体系分散至成千上万个pL-nL体积液滴中,缩短显色因子的积累时间,从而能够以较短时间到达可检测范围继而完成显色液滴的计数。在这里,细菌的分散入液滴的过程是随机的,服从泊松分布。因而,活菌的绝对定量可以依据泊松分布实现。然而,已发展的DDCA仍未摆脱病原的分离培养步骤,CRO表型鉴定仍需要较长的周转时间。基于此背景,广州市第一人民医院刘大渔课题组开发了一种CRO免分离培养的表型鉴定方法,该方法将样本级联过滤(Cascade filtration, CF)与DDCA集成于微流控芯片中(CF-DDCA),详见图1。CF根据细胞大小选择性回收革兰氏阴性(G-)杆菌,得到的细菌与抗生素(+/-)溶液在负压驱动下被引入DDCA单元中分散入液滴,再根据抑菌率实现CRO的鉴定。
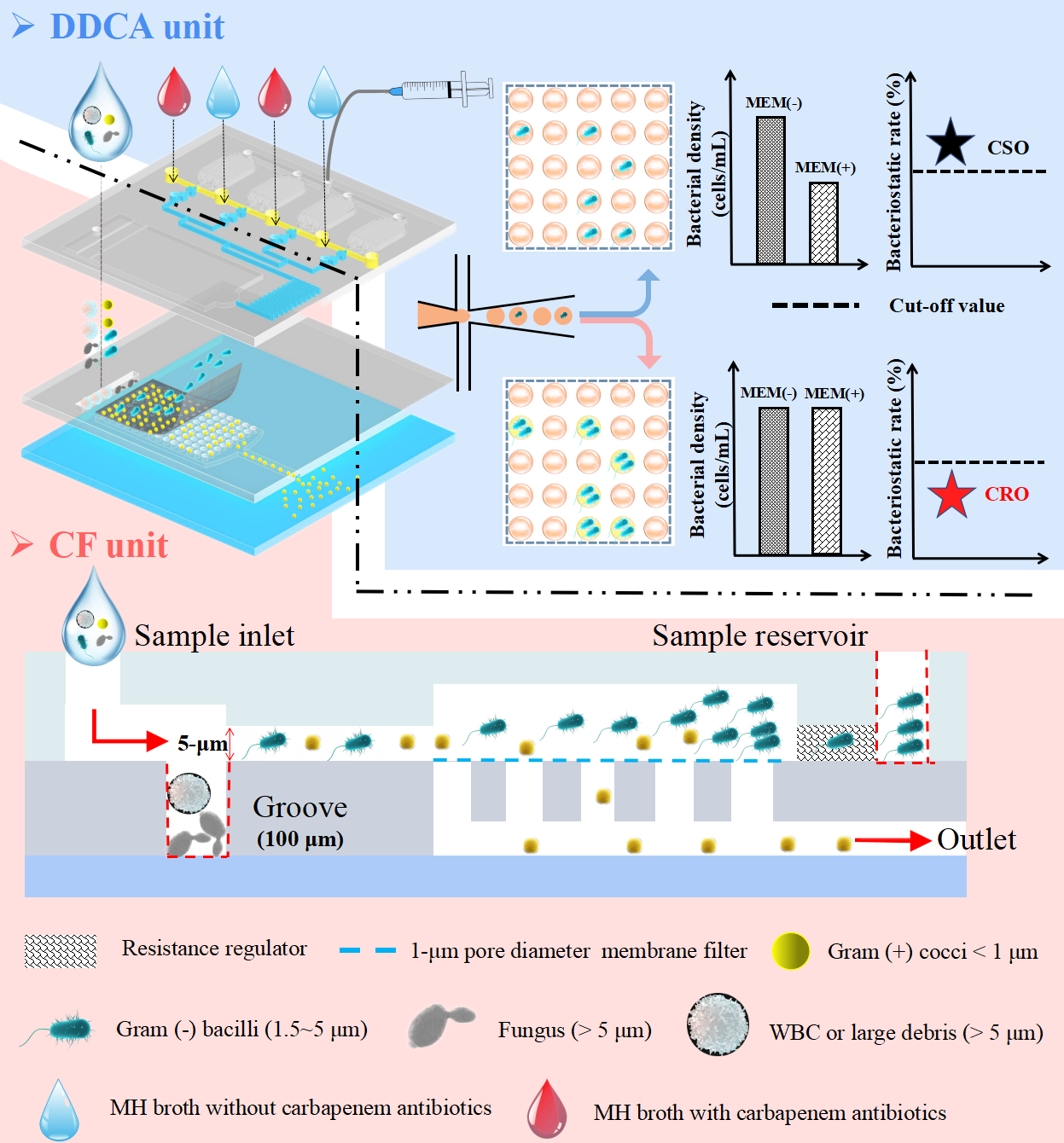
图1 CF-DDCA实现CRO免分离培养表型鉴定的流程图。上游的CF单元通过以下结构设计完成G-(1.5~5 μm)的选择性回收:白细胞、真菌或者组织碎片被5 µm高的间隙截留并困于100µm深的凹槽;<1 μm的革兰氏阳球菌(G+)进入1 μm PC膜流入废物通道。下游的DDCA单元中,注射器抽真空实现液滴中细菌的分散和封装。CRO的存在由抗生素暴露组(+)与阴性对照组(-)计算所得的抑菌率来表示。
作者首先研究了优化了液滴中四种G-的显色时间。如图2A所示,由于不同细菌的增殖速率不同,使得液滴中显色信号积累速率也存在差异,但都能在3小时内达到检测阈值(S/N=2)。作者也对传统培养法和液滴数字化分析进行了一个比较,结果显示基于毫升体系的细菌培养与输入的细菌密度相关:细菌密度越高,检出时间(TTP)越短。这样的规律在DDCA中并不存在(图2B),证明了DDCA具有缩短显色时间的能力和对低密度细菌样本的适用性。然后,作者评估了DDCA的细菌定量能力(图3A,B)和碳青霉烯抑菌率的检测能力(图3C,D)。连续稀释的菌悬液定量结果显示了DDCA具有良好的定量精度(R2=0.99418)。碳青霉烯敏感和耐药分离株抑菌率实验证明了DDCA可以完成CRO的鉴定(P < 0.01)。
其次,作者利用非相关微生物和四种G-的混合样本验证了CF单元对G-的选择性回收能力。如图4A显示,两种非相关微生物在过滤后密度均下降了99.9%以上(107→104CFU/mL),而四种G-的菌密度没有显著变化(p > 0.05)。而当干扰密度<104 CFU/mL时,液滴阳性率仅受到0.02%的干扰(图4B)。除此之外,作者还在107CFU/mL的CRO/CSO中加入相关浓度的真菌/阳性菌,证实了CF-DDCA实际抗干扰能力(图5)。
最后,作者利用65例尿液感染(UTI)样本完成了CF-DDCA的临床应用价值评价。如图6所示,CRO阳性率为89.47%(17/19),阴性率为100%(46/46),一致性为96.92%(62/65),Kappa值为0.92,表明CF-DDCACRO鉴定结果的可靠性。对于出现假阴性的2例样本,作者解释说:因其仅研究了美罗培南(S/R),而这2例样本对亚胺培南耐药,对美罗培南敏感,是检测范围的不足。
总地来说,该研究所开发的CF-DDCA微流控分析系统无需耗时的病原分离培养,在3.5小时内即可实现CRO的表型鉴定,操作简单,有潜力发展为临床上快速、自动化的CRO鉴定工具。
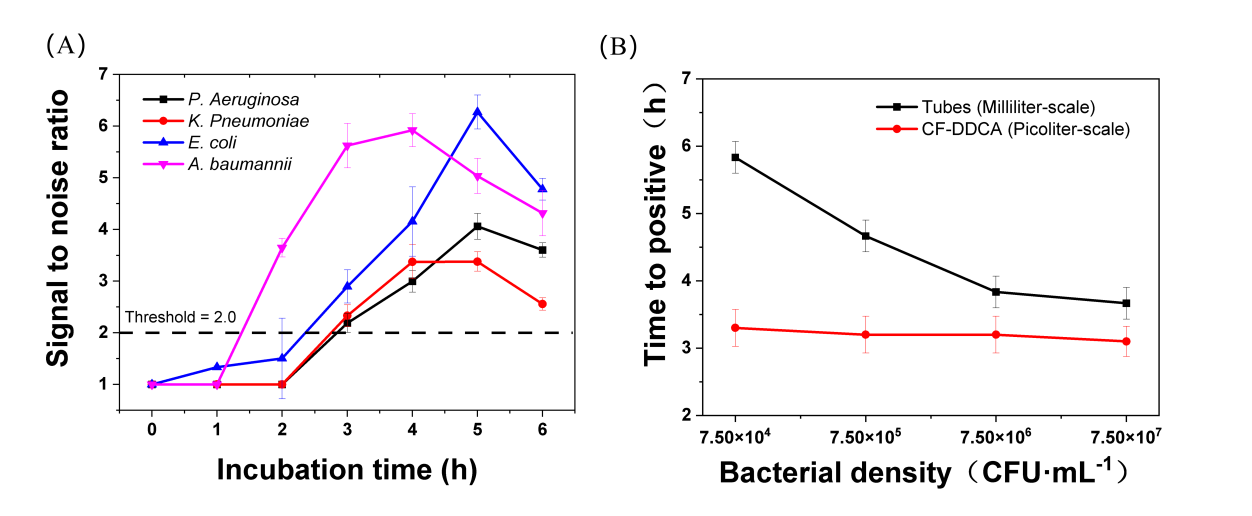
图2 A)液滴中不同细菌的培养时间优化,包括大肠杆菌、肺炎克雷伯菌、铜绿假单胞菌和鲍曼不动菌;B)利用含有不同密度大肠杆菌的菌悬液比较DDCA和基于毫升体积培养方法的检出时间。
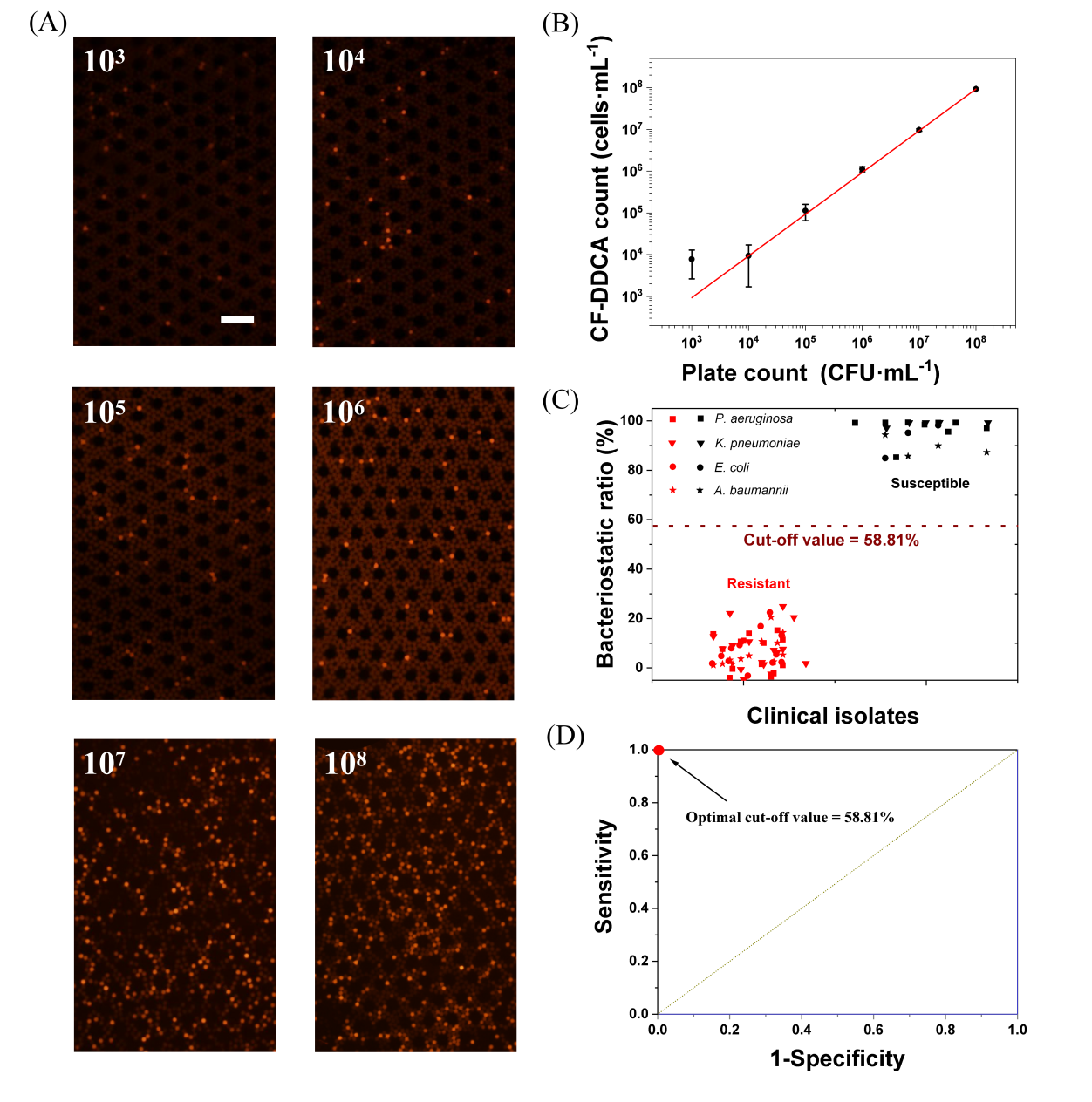
图3 DDCA检测碳青霉烯类抑菌率:A)浓度梯度菌悬液的DDCA孵育结果,其中显色液滴表示液滴含有活菌;B)DDCA与平板菌落计数法对浓度梯度菌悬液定量值间的线性相关性;C)DDCA确定的CSO和CRO的抑菌率;D)ROC分析,以确定鉴定CRO的最佳抑菌率阈值。

图4 CF对G-的选择性回收效率评价。A)大肠杆菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌、粪肠球菌和真菌的输入浓度与检出浓度的比较;B)液滴阳性率与输入细菌密度的关系;C-D)图A过滤前后样品池的荧光图片(Syto9)。
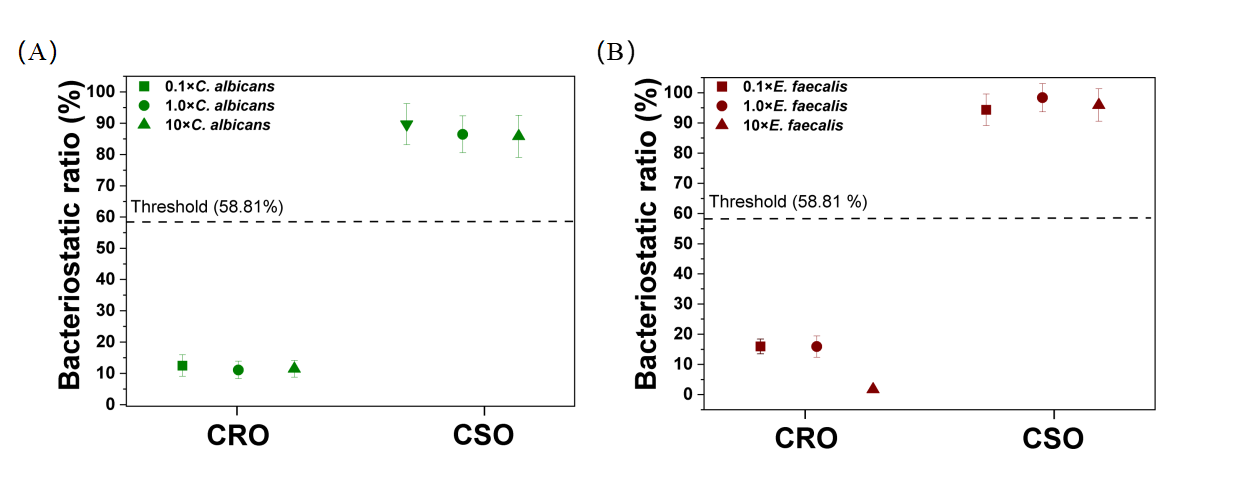
图5 人工模拟多重感染样本证明CF-DDCA的抗干扰能力。样本中含有0.1×、1×和10×白色念珠菌A)和含有0.1×、1×和10×粪肠球菌B)下CSO/CRO的鉴定。

图6 CF-DDCA的临床应用价值评价。常规表型法测定UTI样本中致病微生物有G-,G+,真菌。DDCA测定了相关微生物的密度和对美罗培南的反应。红色星号表示DDCA与临床报告结果不一致的样本。
论文索引:http://dx.doi.org/10.2139/ssrn.4177985
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942

