mcr-1阳性菌株产生的外膜囊泡对粘菌素敏感大肠杆菌的保护作用减弱
在过去几年中,粘菌素耐药性逐渐增加,了解粘菌素耐药性的机制,开发针对粘菌素耐药超级细菌的新治疗策略具有重要意义。粘菌素属于两亲性多肽抗生素。粘菌素的杀菌作用包括最初与革兰氏阴性菌外膜中的脂多糖(LPS)静电结合,从而产生Ca2+和Mg2+的置换,然后脂肪酰基链插入外膜,导致细胞内容物泄漏。革兰氏阴性菌对粘菌素耐药性的最明确机制涉及对LPS的修饰。在大肠杆菌中,4氨基-4-脱氧-L-阿拉伯糖、磷酸乙醇胺(pEtN)和/或半乳糖胺修饰脂质A,导致LPS的负电荷减少,粘菌素和LPS之间的相互作用减少。虽然参与大多数这些修饰的基因都是染色体编码的,但2016年报道了第一个赋予质粒介导抗性的动员粘菌素抗性基因(mcr-1),并对粘菌素耐药性在全球的传播构成了巨大威胁。MCR-1酶属于磷酸乙醇胺(pEtN)转移酶家族,附着在革兰氏阴性菌的内膜上。大肠杆菌中,mcr-1基因的表达导致向脂质A中添加磷酸乙醇胺,并对粘菌素产生耐药性。
先前的研究表明,添加外膜囊泡(OMVs)可使大肠杆菌和丁香假单胞菌对粘菌素产生耐药性,然而,潜在的分子机制尚未完全阐明。
主要内容:
1、大肠杆菌OMVs的物理特性
该研究使用了大肠杆菌K12和同基因大肠杆菌50434(带有mcr-1基因的大肠杆菌K11)。对这些菌株的OMVs进行了纯化。透射电子显微镜分析显示,这些大肠杆菌菌株在生长的对数后期释放OMVs。囊泡为球形,直径范围为50至200纳米(图1A、B)。OMVs的纳米颗粒跟踪分析(NTA)确定,从大肠杆菌08-85和大肠杆菌K12分离的OMVs的中值直径分别为134.2和124.9 nm(图1C、D)。两种方法对囊泡的大小分布基本一致。
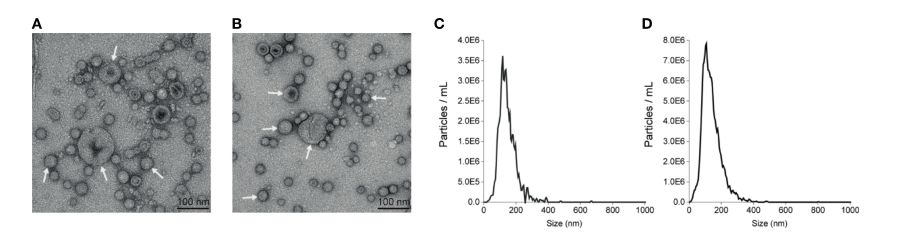
图1 大肠杆菌08-85、K12 OMVs物理表征
2、OMVs保护一株易感大肠杆菌免受粘菌素感染
从临床大肠杆菌ATCC25922和大肠杆菌08-85以及大肠杆菌K12和大肠菌50434中纯化了OMVs,并研究了OMVs对细菌生长的影响和对粘菌素的杀伤作用。粘菌素对大肠杆菌的MIC为1 μg/ml,而粘菌素对大肠杆菌ATCC25922和大肠杆菌K12的最低杀菌浓度(MBCs)为2 μg/ml。
用2×MIC粘菌素(2 μg/ml)处理与0.2至20 μg/ml范围内的系列OMV孵育的大肠杆菌ATCC25922或大肠杆菌K12,以确保细菌不会在该浓度下生长。如图2A、B所示,在没有OMVs的情况下,大肠杆菌ATCC25922或大肠杆菌K12的细菌细胞根本没有生长。OMVs以浓度依赖的方式保护大肠杆菌ATCC25922免受生长抑制,20 μg/ml OMVs使细菌细胞生长最快,0.2 μg/ml OMVs使细菌细胞最慢或不生长(图2A)。值得注意的是,在相同浓度下,来自mcr-1阳性菌株大肠杆菌08-85的OMVs比从大肠杆菌ATCC25922分离的OMVs提供的保护更少(图2A)。同样,大肠杆菌K12受到20 μg/ml大肠杆菌K12-OMVs的保护,而在最初的12小时内,大肠杆菌50434OMVs完全抑制了生长(图2B)。
在杀伤保护试验中(图2C、D),单独的细菌细胞(黑条)和含有粘菌素的细菌细胞分别作为阳性和阴性对照(2 μg/ml,绿条)。对于临床大肠杆菌ATCC25922(图2C),与阴性对照相比,20 μg/ml大肠杆菌ATCC2 5922 OMVs和20 μg/ml E.coli 08-85 OMVs都提供了免受粘菌素治疗的保护。然而,当与2 μg/ml OMVs孵育时,细菌细胞被大肠杆菌ATCC25922 OMVs完全保护,但不被大肠杆菌08-85的OMVs保护。0.2 μg/ml的大肠杆菌ATCC25922或大肠杆菌08-85的OMVs不能保护大肠杆菌ATCC2 5922对抗粘菌素。如图2D所示,与没有OMVs的大肠杆菌K12相比,20 μg/ml大肠杆菌K12-OMVs保护对粘菌素敏感的大肠杆菌K1 2免受粘菌素处理。然而,添加20 μg/ml大肠杆菌50434 OMVs对粘菌素的保护作用显著减弱。2 μg/ml大肠杆菌K12 OMVs和2 μg/ml E.coli 50434 OMVs都不能保护E.coli K12免受粘菌素的侵害。这些结果表明,与相同浓度的mcr1阴性菌株相比,来自mcr-1阳性菌株的OMVs减弱了保护作用。
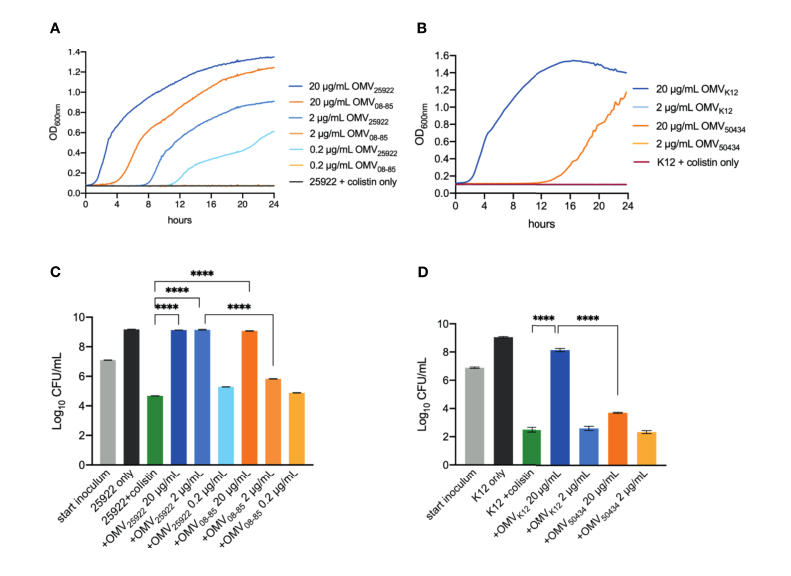
图2 生长曲线(A,B)和杀伤保护试验(C,D)
3、该保护作用与OMVs对粘菌素的吸收有关
了确定OMVs的保护作用在保护测定中观察到的是由于OMVs对粘菌素的吸收,使用结合脂质A的BODIPY TR cadaverine (BC),进行荧光位移测定。BC的荧光通过与脂质A磷酸基团结合而猝灭,并通过对脂质A显示亲和力的化合物去除猝灭的。如图3A所示,OMVs对BC的滴定导致BC荧光的浓度依赖性猝灭。如果粘菌素类似地与OMVs的脂质A结合,它应该取代BC探针并导致荧光强度增加。
10倍系列稀释的粘菌素加入到与2μg/ml大肠杆菌K12或大肠杆菌50434的OMsV预孵育的BC(4mM)溶液中。BC的荧光随着粘菌素浓度的增加而增加,这表明粘菌素以剂量依赖的方式与OMVs结合(图3B)。这些结果表明,在相同浓度下,大肠杆菌K12的OMVs比大肠杆菌50434的OMVs吸收更多的粘菌素,并可以解释mcr-1阳性大肠杆菌菌株的OMVs所提供的减弱保护。
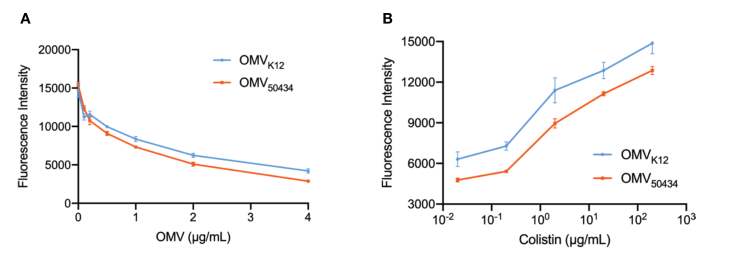
图3 OMVs对BC的滴定(A)和粘菌素(B)取代OMVs结合的BC实验
4、pEtN修饰的脂质A存在于mcr-1阳性大肠杆菌菌株的OMVs中
为了评估结合粘菌素能力的差异是否是由于MCR-1酶引起的脂质A修饰所致,然后分析脂质A含量。从大肠杆菌K12和大肠杆菌50434中纯化的OMVs的脂质A被分离并用LC-MS鉴定。两种未修饰的脂质A,1或4′-磷酸(脂质A-P,m/z为1716.2)和1,4-二磷酸(脂质A-2P,m/z为1796.2)被证实存在于大肠杆菌K12和大肠杆菌50434 OMVs中。在大肠杆菌50434的OMVs中观察到连接到这些未修饰的脂质A、脂质A-P-pEtN(m/z为1839.2)和脂质A-2P-pEtN(m/z为1919.2)的单个pEtN。(图4A,B)。
计算检测到的脂质A种类的相对量。无论是否用pEtN修饰,具有两个磷酸基团的脂质A物种都比只有一个磷酸基团更丰富(图4D)。有趣的是,与细菌细胞相比,OMVs中存在较少的pEtN修饰的脂质A,其组成分别为46%和60%(图4C)。
这些结果证实了pEtN修饰的脂质A存在于mcr-1阳性大肠杆菌菌株的OMVs中。这可以解释为什么在相同浓度下,mcr-1阳性菌株的OMVs与mcr-1阴性菌株的OMVs相比具有减弱的保护作用。有趣的是,我们注意到细菌细胞和大肠杆菌50434的OMVs之间pEtN修饰的和天然脂质A的相对量是不相同的;未修饰的脂质A更有可能分泌到OMVs中,并且pEtN修饰的脂质A在细菌细胞中富集。
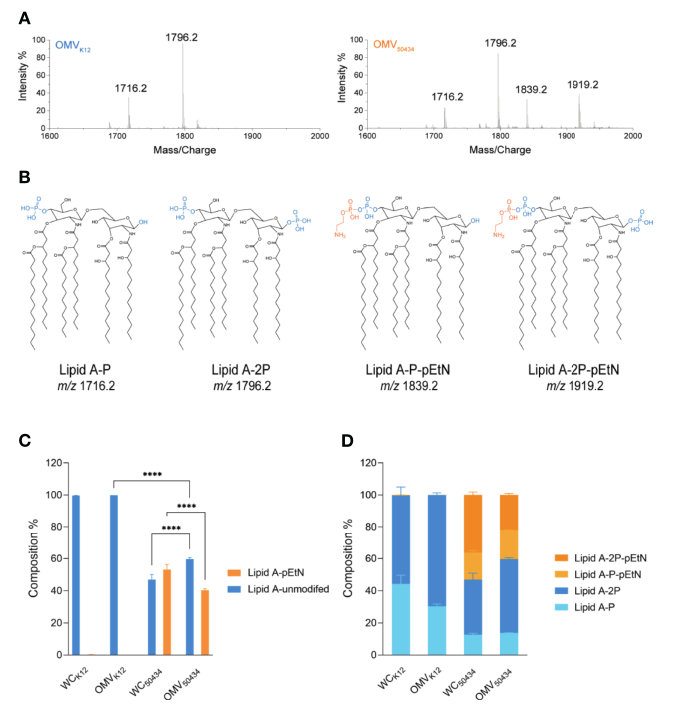
图4 LC-MS对OMVs和生产全细胞(WC)中脂质A的表征和相对定量
5、一株携带mcr-1基因的大肠杆菌产生了更多的OMVs
最后,研究了mcr-1基因对OMVs产生的影响。通过亲脂性染料FM4-64的荧光测量脂质含量来确定来自大肠杆菌K12或大肠杆菌50434的OMVs的相对浓度。通过除以CFU/ml的数量来归一化OMVs的产生,并且计算相对倍数的OMVs产生,因为这些值被进一步除以对照条件的OMVs的生成。与大肠杆菌K12相比,mcr-1阳性大肠杆菌50434释放的OMVs增加了2.5倍(图5A)。对于菌株大肠杆菌50434,与不含粘菌素生长的大肠杆菌50434相比,在粘菌素压力(2 μg/ml)下生长导致OMVs产量显著增加(增加2.3倍)(图5B)。
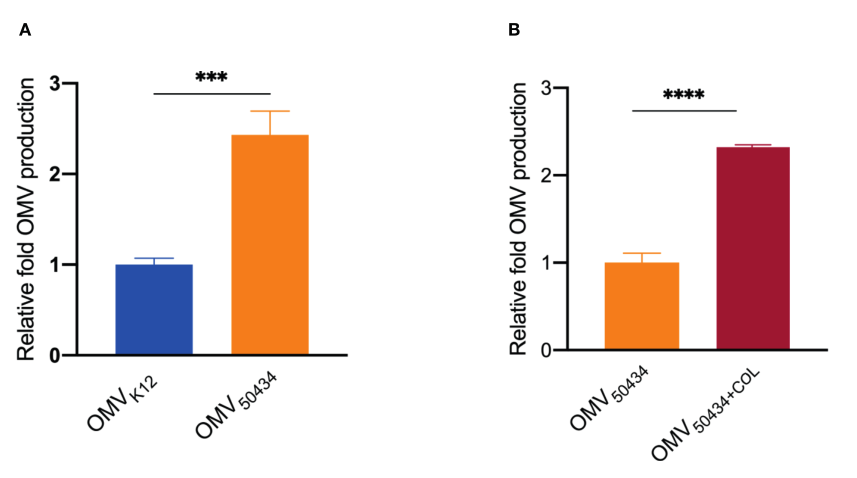
图5
参考文献:Li X, Sun L, Li C, Yang X, Wang X, Hu X, Nie T, Zhang Y, You X. The Attenuated Protective Effect of Outer Membrane Vesicles Produced by a mcr-1 Positive Strain on Colistin Sensitive Escherichia coli. Front Cell Infect Microbiol. 2021 Jul 28;11:701625. doi: 10.3389/fcimb.2021.701625. PMID: 34395312; PMCID: PMC8355893.
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942

