姜黄素调控构建缺陷锌基聚合物金属有机框架,作为高效伤口愈合的长效抗菌平台
摘要:以1,4-邻苯二甲酸基聚醚聚合物(L8)为配体、姜黄素为调节剂、Zn2+为金属配位中心合成了一种有缺陷的锌基金属有机框架复合材料(Cur@Zn-MOF),并以此为基础建立了一个双模式抗菌平台,用于高效愈合细菌感染的伤口。Cur@Zn-MOF生物平台除了综合了以L8为配体合成的聚合物-MOF(如高水稳定性、Zn2+的可控和长期释放)和以姜黄素为配体制备的Zn-bioMOF(如姜黄素和Zn2+的可行释放和良好的生物相容性)的特点外,还具有大量的结构缺陷。与单独使用配体合成的Zn-bioMOF和polyZn-MOF相比,缺陷的Cur@Zn-MOF在48 h的长期释放过程中,姜黄素的释放量(6.08 μg mL-1)更小,Zn2+离子的释放量(5.68 μg mL-1)更高。这种协同效应使得Cur@Zn-MOF即使在125 μg mL-1的低用量下也能对大肠杆菌和金黄色葡萄球菌起到很好的杀菌作用。体内伤口愈合效果进一步证实了Cur@Zn-MOF对细菌感染伤口的卓越治疗能力。此外,Cur@Zn-MOF的细胞毒性可忽略不计,溶血率低,大大提高了人体皮肤成纤维细胞的活力。因此,这项工作可以提供一种基于Cur@Zn-MOF功能的新型双模式生物平台。
图1 Cur@Zn-MOF的合成过程示意图及表征
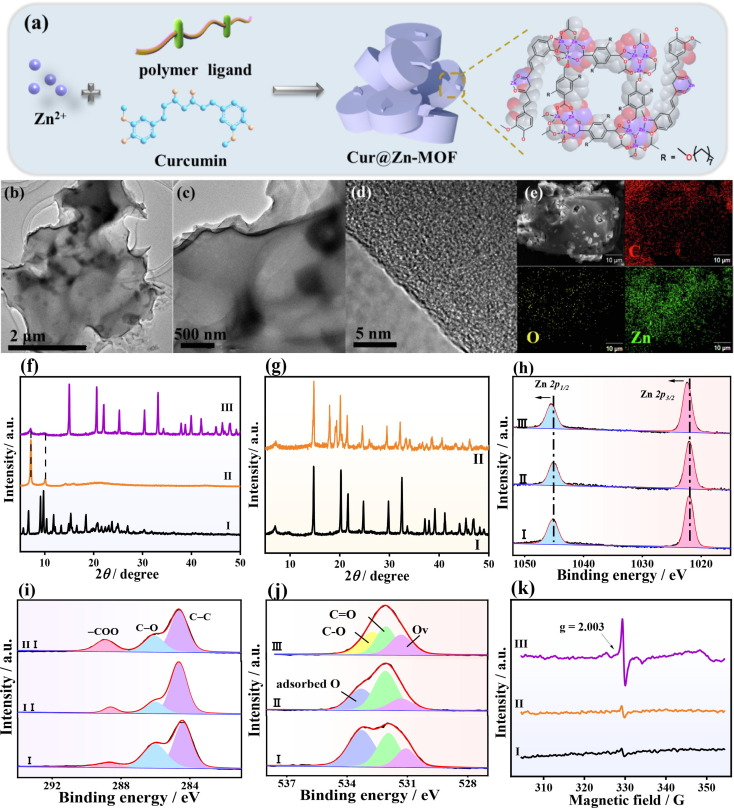
本文以1,4-邻苯二甲酸基聚醚聚合物(L8)为配体,姜黄素为调节剂,Zn2+为金属配位中心,合成了一种新型的Cur@Zn-MOF,并进一步将其作为抗菌纳米治疗平台用于细菌感染伤口的愈合(图1a)。Cur@Zn-MOF不仅由Zn2+节点和姜黄素组成,还具有优异的化学稳定性、较大的比表面积和分层孔结构,以及大量的金属簇缺陷。得益于三维聚合物网络和不规则骨架,Cur@Zn-MOF具有较高的水稳定性和姜黄素与Zn2+的长效释放。因此,与polyZn-MOF和Zn-bioMOF相比,Cur@Zn-MOF的Zn2+释放量更大(6.08 μg mL-1),而姜黄素的释放水平较低(5.68 μg mL-1)。此外,Cur@Zn-MOF在低浓度(125 μg mL-1)时即可实现对大肠杆菌和金黄色葡萄球菌的超长生长抑制(24 h)。由于Cur@Zn-MOF具有良好的生物相容性,因此对金黄色葡萄球菌感染伤口的愈合和组织恢复具有促进作用。本研究通过利用姜黄素构建用于伤口愈合的缺陷,提供了一种新的基于MOF的抗菌平台。
Cur@Zn-MOF与polyZn-MOF和Zn-bioMOF相比具有完全不同的形态特征(图S3),表现出明显的大尺寸和圆形棋子形状。Cur@ZnMOF的低倍和高倍TEM图像(图1b和c)验证了其纳米板状结构。同样,在Cur@Zn-MOF的HR-TEM图像(图1d)中也没有发现明显的晶格。因此,姜黄素的引入有效地调节了聚Zn-MOF的纳米结构。此外,Cur@ZnMOF的能量色散X射线光谱(EDX)图(图1e)表明,C、O和Zn在整个选定区域均匀分布。这进一步证实了合成的Cur@Zn-MOF并不是Zn-bioMOF和polyZn-MOF的简单混合物,而是呈现出一种新的配位结构。此外,还利用ICP-MS技术检测了不同MOF中的锌含量。结果表明,Cur@Zn-MOF的锌含量为16.9 wt%,高于Zn-bioMOF(锌含量为8.7 wt%)和polyZn-MOF(锌含量为12.4 wt%)。显然,富含缺陷的Cur@Zn-MOF网络可以捕获高含量的Zn节点,通过向环境系统释放Zn2+离子来提高抗菌性能。此外,Zn-bioMOF的氮吸附-解吸等温线(曲线I,图S4a)表现出I型吸附-解吸行为,表明其具有微孔结构。
Zn-bioMOF的功率X射线衍射(PXRD)图(曲线I,图1f)显示了2θ≈5.6°、6.7°和9.8°处的衍射峰,这与所报道的结构(medi-MOF-1,C42H34O12Zn3)十分吻合。在聚Zn-MOF的PXRD图谱中发现了两个特征衍射峰,分别位于2θ≈7.2°和10.0°处(曲线II,图1f),分别对应于(200)和(220)平面。这与Cohen’s
polyMOFs和母体MOF-5的图谱一致。具体而言,Cur@Zn-MOF的PXRD图谱(曲线III,图1f)包括2θ≈7.2°和10.0°处的特征衍射峰,与polyZn-MOF非常吻合。这表明姜黄素单元的存在并没有改变polyZn-MOF的拓扑结构。此外,出现在15°以上的主峰可能是无孔配位化合物(图S5)。如图1a所示,在使用姜黄素作为调制剂时,锌(II)离子优先与聚合物配体配位。值得注意的是,羟基上的O原子与Zn(II)的结合力要强于甲氧基。因此,Zn(II)团簇最有可能与姜黄素的羟基配位。为了阐明所制备MOFs结构的稳定性,我们对在PBS(0.1 M,pH 7.4)中分散12 h后的polyZn-MOF、Zn-bioMOF和Cur@Zn-MOF进行了PXRD图谱分析。图S6a显示,Zn-bioMOF在PXRD图谱中的衍射峰完全消失。这验证了Zn-bioMOF在生理体系中的溶液稳定性很差,因此无法通过释放Zn2+离子作为可控生物平台。相比之下,polyZn-MOF的PXRD图样(图S6b)在同一时期内没有发生实质性变化,这表明它具有很高的稳定性。此外,Cur@Zn-MOF的PXRD图样(图1g)在浸泡后也只发生了轻微变化,但仍保留了主要特征峰。因此,聚合物配体的引入可以显著提高Zn-bioMOF的结构稳定性,使Zn-MOF具有长效抗菌作用。
这三种MOFs的X射线光电子能谱(XPS)勘测扫描光谱显示出清晰的C 1s(284.6 eV)、O 1s(531.4 eV)和Zn 2p(1022.0 eV)信号(图 S8)。如图1h所示,三种MOF的Zn 2p XPS光谱包括Zn 2p3/2和Zn 2p1/2。与polyZn-MOF和Zn-bioMOF相比,Cur@Zn-MOF的Zn 2p转移到了高结合能位置(0.3 eV)。这表明发生了从O相关基团到Zn节点的电子转移。同时,C-C(284.6 eV)、C-O(286.2 eV)和COO(288.6 eV)三个基团出现在三种MOF的C 1s高分辨率XPS光谱中(图1i)。Cur@Zn-MOF中COO基团的峰面积归因于前驱体中的醋酸盐。Zn-bioMOF和polyZnMOF的O 1s XPS光谱(图1j)包括氧空位(Ov,531.1 eV)、C=O(531.9 eV)和吸附O(533.3 eV)。其中,MOFs表面不饱和配位引起的Ov物种大大提高了活性氧的生成。此外,在Cur@Zn-MOF的O 1s XPS光谱中发现了Ov、C=O和C-O(532.8 eV)。与Zn-bioMOF和polyZn-MOF相比,Cur@Zn-MOF中的Ov含量明显提高。电子顺磁共振分析(EPR)结果进一步证实了这一结果。如图1k所示,Cur@Zn-MOF(曲线III)在g = 2.003处的EPR信号高于ZnbioMOF(曲线I)和polyZn-MOF(曲线 II),表明Zn与O的不饱和配位导致其缺陷含量较高。因此,制备Zn基MOF复合材料的小分子调节剂(姜黄素)明显增加了缺陷位点或活性位点的数量。
图2 姜黄素和Zn2+离子的释放行为
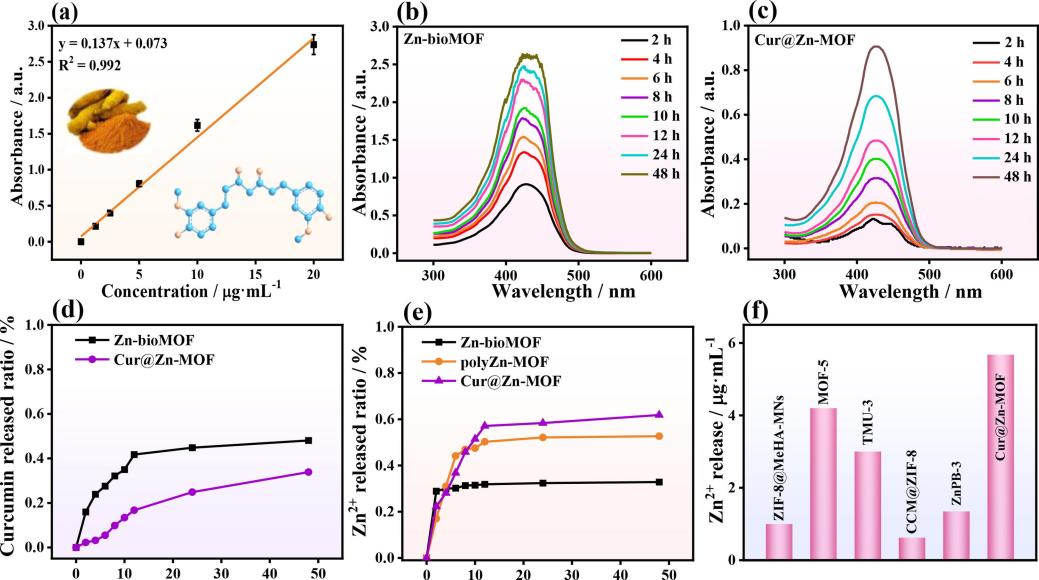
姜黄素在ZnbioMOF和Cur@Zn-MOF中的释放行为是根据姜黄素标准曲线(图2a)在426 nm波长处的紫外可见光谱进行评估的(图2b和c)。图2d显示了姜黄素从ZnbioMOF和Cur@Zn-MOF中的释放率。48 h后,姜黄素从Cur@Zn-MOF中的最大释放率为33.8%(6.08 μg mL-1),大大低于Zn-bioMOF的释放率(48.1%,18.46 μg mL-1)。这一发现主要归因于Cur@ZnMOF的水稳定性增强。图2e表明,一定含量的Zn2+离子迅速从MOF中释放出来,随后达到平衡。Cur@Zn-MOF需要10 h才能达到平衡,比polyZn-MOF(6 h)和Zn-bioMOF(2 h)要长。因此,Cur@Zn-MOF中Zn2+离子的最终释放率约为61.8%(5.68 μg mL-1),高于ZnbioMOF(32.8%,4.58 μg mL-1)和 polyZn-MOF(52.7%,3.50 μg mL-1)。因此,Cur@Zn-MOF实现了Zn2+的长期可控释放。此外,与ZIF-8@MeHA-MNs (1 μg mL-1)、MOF-5 (4.2 μg mL-1)、TMU-3 (3 μg mL-1)、ZnPB-3 (0.622 μg mL-1)和CCM@ZIF-8-PT (1.35 μg mL-1)等其他基于Zn-MOF的抗菌平台相比,所制备的Cur@Zn-MOF具有相对较高的Zn2+释放量(图2f)。
图3 体外抗菌活性
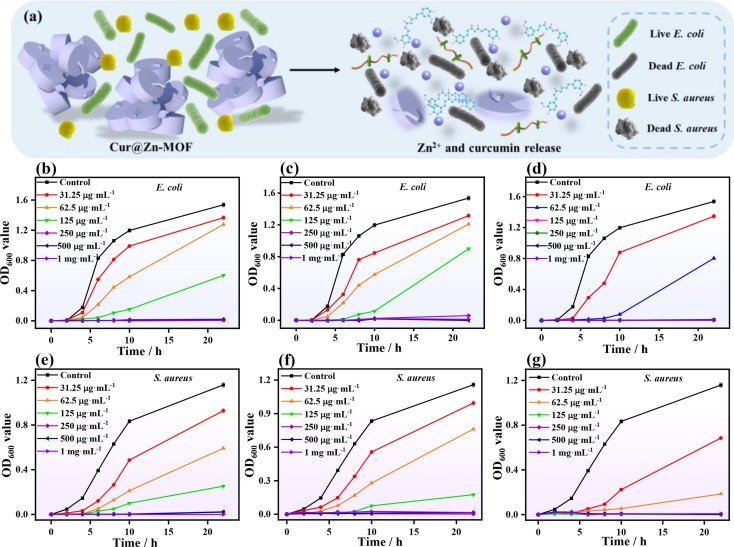
基于所开发的抗菌平台中姜黄素和Zn2+离子的高效释放,研究了Zn-bioMOF、polyZn-MOF和Cur@Zn-MOF对大肠杆菌和金黄色葡萄球菌的体外抗菌活性(图3a)。如图S11所示,对照组没有观察到对两种细菌的抑制区,而涂覆ZnbioMOF、polyZn-MOF和Cur@Zn-MOF的组则出现了明显的抑制区。很明显,Zn2+离子和姜黄素向周围扩散,导致相应区域的细菌失活。其中,Cur@Zn-MOF的抑菌区在所有组别中最大(表S1),显示出姜黄素和Zn2+的可控和长期释放所带来的卓越抗菌性能。更有趣的是,Cur@Zn-MOF对金黄色葡萄球菌的抑菌区大于对大肠杆菌的抑菌区。一般来说,革兰氏阴性菌具有复杂的细胞壁结构,因此存活率高于革兰氏阳性菌。
此外,还通过监测细菌生长曲线对Cur@Zn-MOF的抗菌特性进行了定量评估。未使用抗菌剂的大肠杆菌的生长呈现出典型的生长模式,包括滞后期、对数期和高原期。经MOF处理的各组对细菌生长的抑制作用随MOF浓度的增加而增强,表明释放的Zn2+和姜黄素能抑制细菌的生长。对于Zn-bioMOF(图3b),当浓度为125 μg mL-1时,大肠杆菌的生长在最初的6 h内受到了明显的抑制,之后随着培养时间的延长,细菌悬浮液的浊度逐渐增加,这表明当浓度为125 μg mL-1时,Zn-bioMOF并不能完全抑制细菌的生长。如前所述,Zn2+和姜黄素的释放行为在10 h后趋近于一个平台,无法提供长效抗菌能力。此外,在大肠杆菌对polyZn-MOF的抑菌结果中也获得了类似的抑制行为(图3c)。在含有62.5 μg mL-1 Cur@Zn-MOF的情况下(图3d),大肠杆菌的生长曲线出现了明显的移动,这表明Cur@Zn-MOF对细菌的生长有很强的抑制作用。当Cur@Zn-MOF的浓度增加到125 μg mL-1后,大肠杆菌的OD600值在22 h内没有增加,表明细菌已被完全杀死。因此,该浓度被确定为最低抑菌浓度。图3e-g表明,用各种抗菌剂处理金黄色葡萄球菌的抗菌行为与大肠杆菌的抗菌行为结果相似。与其他基于Zn-MOF的抗菌平台相比,Cur@Zn-MOF表现出更优越的抗菌性能(表S2),这归因于以下因素:(i) 细菌细胞膜上的磷酸基团与带正电荷的Zn2+之间产生静电作用,导致Cur@ZnMOF在细胞膜上聚集;(ii) Cur@Zn-MOF在酸性环境中被降解,导致Zn2+离子和姜黄素缓慢而持续地释放;(iii) 细菌膜中的蛋白质和脂肪酸很容易被Cur@Zn-MOF中释放的姜黄素氧化,破坏细胞膜的完整性,进一步导致细胞死亡;(iv) 當Zn2+離子和姜黃素進入細胞後,會與細胞核產生作用,破壞DNA或蛋白酶,從而殺死細菌和阻礙細菌繼續生長。
图4 平板计数法评估抗菌效率
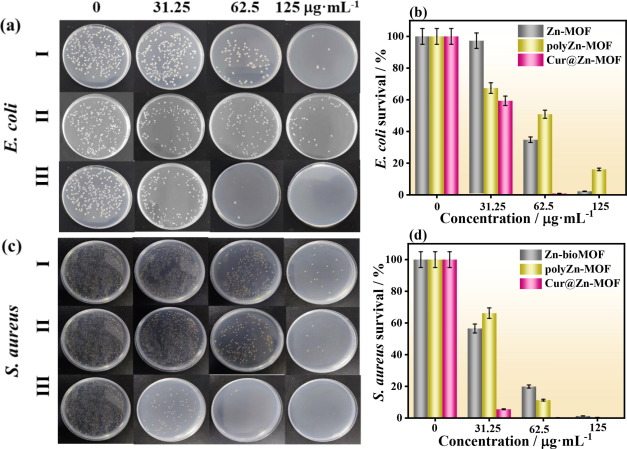
为了进一步证实这三种MOFs对大肠杆菌和金黄色葡萄球菌的抗菌性能,我们采用平板菌落计数法来证明其抗菌效率(图4a和c)。值得注意的是,在琼脂平板上培养细菌24 h后,随着MOF用量的增加,各组大肠杆菌和金黄色葡萄球菌的菌落数都逐渐减少。同时,与Zn-bioMOF组和polyZn-MOF组相比,Cur@Zn-MOF组中两种细菌菌株的形成数量明显减少。在浓度为31.25 μg mL-1时,大肠杆菌对Zn-bioMOF、polyZn-MOF和Cur@Zn-MOF的存活率分别为97.32%、67.41%和59.38%(图4b)。此外,当浓度为62.5 μg mL-1时,Zn-bioMOF、polyZn-MOF和Cur@Zn-MOF组的细菌活力分别降至34.82 %、50.89 %和0.89 %。当Cur@ZnMOF的浓度增加到125 μg mL-1时,杀菌效率达到100%。而Zn-bioMOF、polyZn-MOF和Cur@Zn-MOF对金黄色葡萄球菌的细菌存活率分别约为1.32%、0.35%和接近0(图4d)。这些发现与上述分析一致,表明Cur@Zn-MOF对大肠杆菌和金黄色葡萄球菌的抗菌活性优于其他化合物。
图5 大肠杆菌和金黄色葡萄球菌经PBS、Zn-bioMOF、polyZn-MOF和Cur@ZnMOF处理后的形态FE-SEM图像和活/死荧光共聚焦图像
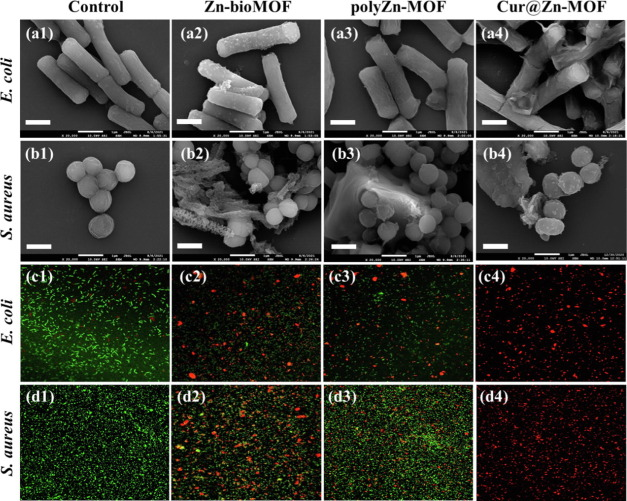
通过FE-SEM研究了细菌经不同MOF处理后的表面形态变化和膜完整性。如图5a1和b1所示,大肠杆菌和金黄色葡萄球菌分别表现出典型的棒状和圆形,保持了光滑完整的膜结构。相比之下,Zn-bioMOF和polyZn-MOF组的部分细菌膜出现收缩。推测细菌膜中的蛋白质和脂肪酸很容易被Zn-MOF中释放的金属离子和姜黄素氧化。然而,许多细菌仍然保持着良好的结构。至于Cur@ZnMOF处理组(图5a4和b4),大肠杆菌和金黄色葡萄球菌的细胞膜都出现了明显的严重变形和塌陷。一些细菌甚至出现细胞内容物渗漏。因此,Cur@Zn-MOF的杀菌能力最强,这与上述结果一致。
具体而言,活菌用钙黄绿素-AM(绿色荧光)染色,死菌用PI标记产生红色荧光。图5c1和d1显示,针对大肠杆菌和金黄色葡萄球菌的PBS组几乎全部显示绿色荧光,表明所有细菌菌株都是活的。而Zn-bioMOF和polyZn-MOF组则出现了一些强烈的红色荧光。因此,Zn-bioMOF和polyZn-MOF通过破坏细菌的细胞膜抑制了细菌的生长。相比之下,Cur@Zn-MOF处理组对大肠杆菌和金黄色葡萄球菌都没有活菌(图5c4和d4),这验证了它对革兰氏阴性菌和革兰氏阳性菌强大而快速的抗菌特性。
图6 体内伤口愈合
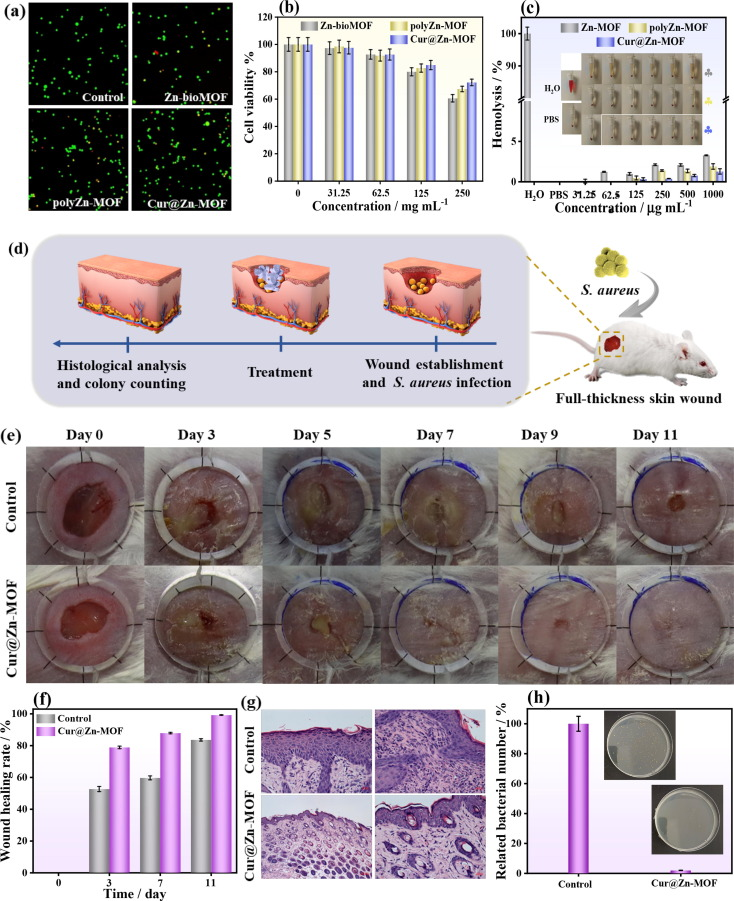
由于高剂量的姜黄素和Zn2+可能会进一步损伤伤口组织,因此研究了抗菌浓度下Cur@Zn-MOF的生物相容性。如图6a所示,采用活/死细胞染色法评估Cur@Zn-MOF(125 μg mL-1)的细胞毒性。各组培养的小鼠成纤维细胞(L929)均显示出均匀的细胞形态和完整的绿色荧光,表明所制备的MOFs对L929细胞的细胞毒性可忽略不计,且具有良好的生物相容性。图6b表明,在31.25和62.5 μg mL-1的低浓度下,Cur@ZnMOF没有发现明显的毒性。然而,当Cur@Zn-MOF的用量为125 μg mL-1时,L929细胞的存活率约为84.9%,这表明其毒性较低。这些结果表明,所开发的Cur@Zn-MOF在生物医学治疗方面具有巨大潜力。此外,还对Cur@Zn-MOF的溶血活性进行了评估。图片(图6c)显示,三组MOFs、阴性对照组(PBS)和阳性对照组(水)之间存在明显的色差。Zn-bioMOF组、polyZn-MOF组和Cur@Zn-MOF组呈金丝雀黄色,与PBS组相似,而水组则呈鲜红色。所有MOFs的定量评价见图6c。其中,即使在1 mg mL-1的高浓度下,Cur@Zn-MOF的溶血率也最低(1.28%),这表明它具有最佳的血液相容性。
随后,我们使用被金黄色葡萄球菌感染的小鼠全厚皮肤伤口模型评估了其体内伤口愈合效果(图6d)。预计细菌可被Cur@Zn-MOF杀死,并诱导明显的血管生成,从而达到伤口愈合的目的。伤口模型形成后,小鼠被分为PBS组和Cur@Zn-MOF组。治疗过程中小鼠体重的变化微乎其微,这也表明Cur@Zn-MOF对小鼠的生物安全性(图 S12)。在第0、3、5、7、9和11天,使用数码相机对伤口愈合过程进行了调查和记录。图6e显示,对照组的感染伤口愈合较差,表明金黄色葡萄球菌感染抑制了伤口的自然愈合过程。与对照组相比,用Cur@Zn-MOF治疗5天后,感染得到了明显的抑制,而对照组的伤口也出现了一些黄色脓液渗出。第7天,Cur@Zn-MOF组的伤口面积明显缩小,而对照组的愈合率仅为46.4%。第11天结束时,Cur@Zn-MOF组的伤口愈合率约为99.2%(图6f),高于对照组的83.6%。此外,还采用H&E染色法评估愈合过程中的组织学效果。图6g表明,与对照组相比,Cur@Zn-MOF组伤口周围的炎症细胞较少,成纤维细胞较多。此外,Cur@Zn-MOF组皮脂腺和毛囊的存在也显示出其出色的伤口愈合性能。由此可见,Cur@Zn-MOF加快了人体皮肤成纤维细胞的活力,增强了杀菌能力,从而改善了伤口修复过程。为了揭示Cur@Zn-MOF的体内抗菌活性,将第11天伤口组织中的细菌培养在LB琼脂平板上。平板计数试验结果(图6h)表明,与PBS组相比,Cur@Zn-MOF存在时伤口组织上的细菌存活率显著下降至2%,与体外抗菌结果一致。总之,所有结果都证明Cur@Zn-MOF能有效抑制细菌生长,加速体内伤口愈合。这归功于Cur@Zn-MOF的协同效应,如抗氧化、抗菌和抗炎能力。
结论:
1、一种富含缺陷的Cur@Zn-MOF被用作新型抗菌平台,通过释放Zn2+离子和姜黄素来实现高效的伤口愈合。与Zn-bioMOF、polyZn-MOF和一些已报道的基于ZnMOF的抗菌平台相比,所建立的Cur@Zn-MOF双模式抗菌平台不仅具有丰富的缺陷、较高的化学稳定性和较大的比表面积,而且由于姜黄素和Zn2+离子在酸性介质中的可控释放而表现出长效抗菌效果。
2、体外抗菌和体内动物实验证实,Cur@Zn-MOF对革兰氏阴性菌(大肠杆菌)和革兰氏阳性菌(金黄色葡萄球菌)均具有广谱抗菌活性,并具有加速皮肤再生和高效伤口愈合的作用。这项研究为基于MOF的高效伤口愈合抗菌平台的发展指明了方向。
参考文献
Yan, F., Cheng, F., Guo, C., Liang, G., Zhang, S., Fang, S., Zhang, Z., 2023. Curcumin-regulated constructing of defective zinc-based polymer-metal-organic framework as long-acting antibacterial platform for efficient wound healing. Journal of Colloid and Interface Science, 641, 59-69. https://doi.org/https://doi.org/10.1016/j.jcis.2023.03.050.
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942

