天然免疫通路中caspases识别和活化IL-18的精确分子机制
天然免疫是机体抵御病原微生物的第一道防线,在清除病原感染和内源危险过程中发挥重要作用。细胞内的天然免疫受体NLR家族蛋白识别病原相关分子模式后会组装成经典的炎症小体(inflammasome)蛋白质复合体,活化下游的蛋白酶caspase-1,进一步切割底物蛋白GSDMD释放其N端结构域的膜打孔活性,激活细胞焦亡的免疫应答。活化的caspase-1还可以切割另外两个重要的炎症性细胞因子IL-1β和IL-18,加工后成熟的IL-1β与IL-18通过GSDMD在细胞膜上形成的分子孔道分泌到细胞外,发挥其促炎性的生理功能。
细胞内的另一类天然免疫受体caspase-4/5以及小鼠的同源蛋白caspase-11可以直接识别革兰氏阴性菌的脂多糖(LPS)而寡聚激活,活化的caspase-4/5/11也通过切割底物蛋白GSDMD介导细胞焦亡的发生,这一通路被称为非经典炎症小体通路(noncanonical inflammasome)。与经典的炎症小体通路主要存在于天然免疫细胞(如单核/巨噬细胞)有所不同,非经典炎症小体通路还广泛存在于许多非免疫细胞中,表明其重要的免疫防御功能,并且caspase-4/5/11已知的生理底物只有GSDMD,是否还有其它在天然免疫中发挥重要功能的底物并不清楚。
2023年11月22日,北京生命科学研究所邵峰团队与中科院生物物理研究所丁璟珒团队合作,在 Nature 期刊发表了题为:Recognition and maturation of IL-18 by caspase-4 noncanonical inflammasome 的研究论文。
该研究发现,炎症因子IL-18是非经典炎症小体通路caspase-4/5的生理底物,并进一步揭示了天然免疫通路中caspases识别和活化IL-18的精确分子机制。

研究人员首先发现,前体形式的IL-18(Pro-IL-18)在许多非免疫细胞系中广泛表达,这些细胞缺少经典炎症小体通路中加工Pro-IL-18的蛋白酶caspase-1,但普遍表达完整的非经典炎症小体通路,利用LPS处理或细菌感染激活胞内的caspase-4,在引起细胞焦亡的同时,也可以显著地介导Pro-IL-18的切割和成熟炎症因子的释放。并且非经典炎症小体通路活化IL-18的现象并不是人类所特有的,其它高等哺乳动物(如猪、兔子等)的caspase-4被LPS激活后也能介导相应物种的Pro-IL-18加工和活化。
随后,研究人员利用纯化的重组蛋白在体外清晰地证明,激活形式的caspase-4可以直接高效地切割Pro-IL-18,其切割位点和caspase-1完全一致,发生在Pro-IL-18前体肽序列(propeptide)的第36位天冬氨酸残基(D36)之后,并且D36之前的四肽序列是切割所必需的。有趣的是,小鼠的Pro-IL-18具有和人的Pro-IL-18完全相同的切割位点四肽序列(LESD),但并不能被caspase-4有效切割,这表明切割位点的四肽序列是caspase-4识别Pro-IL-18的必要条件,但caspase-4还需要其它的位点来特异地识别Pro-IL-18。
为了揭示caspase-4特异地识别Pro-IL-18的分子机制,研究人员尝试解析caspase-4−Pro-IL-18复合物的三维结构,然而二元复合物难以结晶未能获得成功。
研究团队最近的合作工作揭示痢疾杆菌效应蛋白OspC3可以特异地识别并催化宿主caspase-4/11发生全新的ADP-riboxanation翻译后修饰,进而失活caspase-4/11失活,拮抗宿主的免疫防御。利用效应蛋白OspC3特异性结合caspase-4/11的ARD结构域作为辅助因子,研究人员成功地解析了OspC3ARD−caspase-4−Pro-IL-18三元复合物的3.12 Å分辨率的晶体结构。该复合物由caspase-4自剪切活性形式(p20/p10)经典的二聚体分别结合两个Pro-IL-18分子和两个OspC3ARD分子组成, OspC3ARD分别位于caspase-4二聚体的外侧,起到稳定复合物、帮助结晶的作用。而Pro-IL-18以双位点的结合方式对称地结合在caspase-4二聚体界面的上下两端,其中切割位点LESD四肽序列深入caspase-4的酶活中心,形成第一个作用界面。此外,在caspase-4二聚体界面上,由p20亚基C末端和p10亚基N末端形成的分子间β折叠,作为caspase-4的外位点(exosite)与Pro-IL-18的propeptide和附近的结构元件,形成另一个作用界面。有趣的是,研究团队2020年合作发表在Cell上的工作发现,该exosite正是caspase-1/4/5识别焦亡底物蛋白GSDMD的关键位点。
三元复合物的结构也首次揭示了Pro-IL-18精细的结构特征。首先,Pro-IL-18的propeptide通过分子内相互作用与切割后的部分形成完整的球形结构,并直接参与了caspase-4 exosite介导的特异性识别。其次,Pro-IL-18切割后的部分与成熟形式的IL-18在结构上存在显著差异,需要发生剧烈的构象变化和局部的结构重排,产生新的结构元件,而这些新的结构元件对于成熟的IL-18与受体IL-18Rα结合至关重要。这就表明,caspase切割后的IL-18存在一个明确的结构成熟过程,也从机制上解释了pro-IL-18无法结合受体发挥生理功能的原因。
进一步通过序列和结构同源性分析,以及突变实验验证,研究人员证实非经典炎症小体通路的caspase-5和经典炎症小体通路的caspase-1也是通过保守的双位点结合方式特异地识别和活化Pro-IL-18。此外,研究人员还发现小鼠的caspase-11不能有效地切割和活化鼠的Pro-IL-18。在炎症小体研究领域,人们往往使用小鼠作为实验对象与工具,这也是caspase-4−IL-18这条通路长期未被发现的原因之一。而通过序列和结构比较发现,caspase-11的exosite区域负责识别Pro-IL-18的关键氨基酸残基与caspase-4并不保守,破坏了其识别和切割Pro-IL-18的能力,而将这些位点突变成caspase-4对应的残基,可以使caspase-11重新具有加工和活化Pro-IL-18的能力。
这项工作发现并证明了炎症因子IL-18是非经典炎症小体通路活化的caspase-4/5的生理底物,并完整地揭示了天然免疫通路中caspases识别和切割Pro-IL-18,以及Pro-IL-18被加工后成熟为有生理功能的炎症因子的精确分子机制。成熟的IL-18重要的生理功能是诱导INFγ的产生,促进Th1型细胞免疫,非经典炎症小体通路识别和活化炎症因子IL-18的发现,也为天然免疫和适应性免疫的对话提供了全新的理解。
在临床上,血液中高水平的IL-18与多种自身免疫疾病相关,如特异性皮炎,炎症性肠病和幼年特发性关节炎,这项工作为理解这些自身免疫疾病的发生机制以及开发新的干预策略提供了全新的思路。
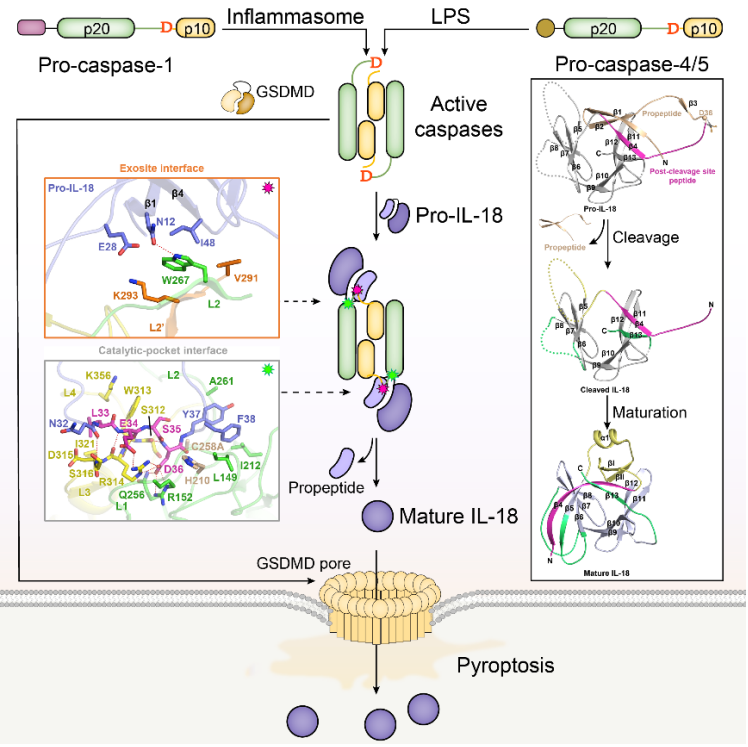
图注:天然免疫炎症小体通路中caspases识别和活化炎症因子IL-18的示意图(图片由邵峰实验室创作,使用需经过作者同意)
论文链接:https://www.nature.com/articles/s41586-023-06742-w
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942

