蛋白酶体组分PSMD14驱动多发性骨髓瘤发生发展的表观调控机制
多发性骨髓瘤(Multiple myeloma)是仅次于淋巴瘤第二高发的血液系统恶性肿瘤,其典型特征为骨髓内浆细胞克隆性恶性增生。半数以上的多发性骨髓瘤患者14号染色体上免疫球蛋白重链(IgH)存在易位,被认为是骨髓瘤发生的驱动事件。其中t(4;14)易位导致组蛋白甲基转移酶NSD2(又称MMSET)异常高表达,这类患者属于中高危基因型,然而患者间疾病进程和预后差别大,亟待进一步的分子分层。
26S蛋白酶体包含一个20S核心颗粒和两个19S调节颗粒。20S核心颗粒的抑制剂硼替佐米自2003年被FDA批准用于多发性骨髓瘤的治疗,至今仍是一线用药。然而绝大部分患者不可避免地耐药复发和进展,近年来19S调节颗粒成为克服硼替佐米耐药的热门靶点。有研究表明抑制19S调节颗粒的固有组分PSMD14呈现抗肿瘤作用,但并不能通过选择性抑制蛋白酶体活性来解释,这暗示PSMD14存在蛋白酶体非依赖的功能。
2023年11月6日,北京大学孙露洋教授课题组(何林副研究员为论文第一作者)在 Molecular Cell 期刊发表了题为:The Proteasome Component PSMD14 Drives Myelomagenesis through a Histone Deubiquitinase Activity 的研究论文。
该研究揭示了蛋白酶体组分PSMD14是一个新的组蛋白H2AK119去泛素化酶,与组蛋白H3K36二甲基转移酶NSD2在染色质上互作,并促进H3K36二甲基的发生,进而导致染色质可及性升高和癌性基因的转录激活。PSMD14不仅可以增加t(4;14)型骨髓瘤患者预后的风险分层,还是克服硼替佐米耐药的潜在干预靶点。

在这项最新成果中,研究团队首先从多发性骨髓瘤细胞的不同亚细胞组分中,质谱检测了PSMD14的蛋白互作组,发现PSMD14在细胞质中与已知的19S调节颗粒组分结合,同时还存在于染色质组分中,并与组蛋白H3K36甲基转移酶NSD2发生相互作用。稳定同位素标记的定量蛋白质组学结果和体内/体外酶活实验表明,PSMD14具有组蛋白H2AK119去泛素化酶活性,并能促进NSD2介导的H3K36二甲基化的发生,证明PSMD14/NSD2是一个新的表观修饰复合体。
随后,表观组学研究结果表明PSMD14与NSD2通过各自的酶活,共同激活包括转录因子RELA在内的参与多发性骨髓瘤发生发展的重要基因的转录。同时RELA能够反过来结合在PSMD14基因的启动子区,继而转录激活PSMD14的表达,形成的PSMD14/NSD2-RELA正反馈环路,驱动多发性骨髓瘤的发生发展。
进一步,PSMD14的小分子抑制剂O-phenanthroline(OPA)和Capzimin能够抑制多发性骨髓瘤细胞增殖,并且能够克服硼替佐米耐药。当与抗骨髓瘤药物如来那度胺、地塞米松联用时,均有效发挥出协同抗肿瘤作用。最后,研究人员对临床数据 (n = 858) 进行分析,发现PSMD14表达水平随骨髓瘤的疾病进展而升高,PSMD14与NSD2共高表达的患者,其预后显著差于两者共低表达的患者,PSMD14可增加中高危骨髓瘤患者的预后分层。
该研究揭示了蛋白酶体固有组分PSMD14未知的表观调控功能,阐明了组蛋白H2AK119去泛素化促进H3K36二甲基化的生化基础,为抑制NSD2活性及其药物开发提供新思路,为多发性骨髓瘤临床耐药提供新的干预靶点和分子分层依据。
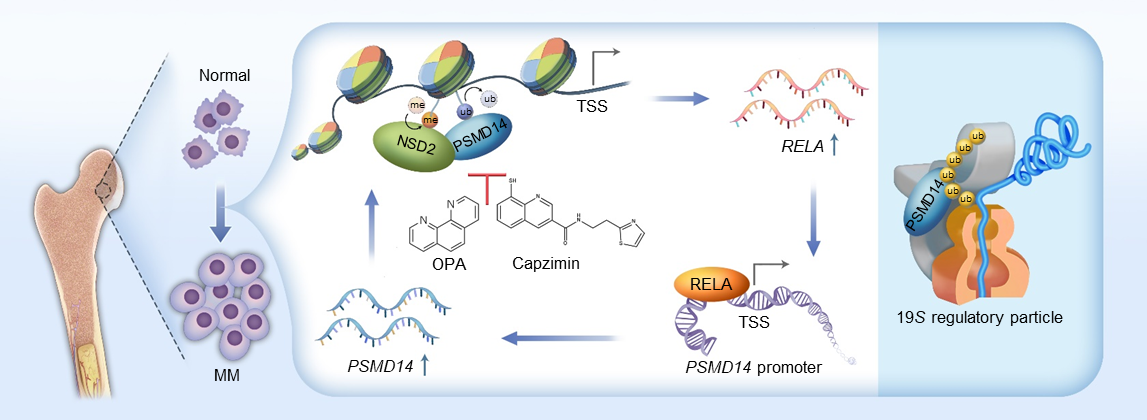
PSMD14/NSD2-RELA正反馈环路驱动多发性骨髓瘤发生发展模式图
论文链接:
https://doi.org/10.1016/j.molcel.2023.10.019
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942

