大豆多肽稳定硒纳米颗粒的制备、表征及体外胆盐结合能力研究
导 读
硒作为人体的一种必需微量营养素,不能被人体合成,只能从体外摄取,且经常以无机硒形式。一些研究已经报道了SeNPs在降低血脂上的作用。然而,SeNPs易于聚集和转变为无活性形式,这限制了它的开发和应用。考虑到SeNPs的低稳定性,许多研究致力于制备稳定的、均一分散的SeNPs,包括添加一定量的生物活性化合物例如多糖、蛋白质和多酚作为分散剂和稳定剂。作为天然生物相容性分子,大豆多肽(SP)富含功能基团,其可以通过相互作用力例如氢键与SeNPs结合,从而改善SeNPs的稳定性和生物相容性。广州大学曾庆祝教授、袁杨副教授研究了大豆多肽(SP)对硒纳米颗粒(SeNPs)的稳定性和潜在的降血脂作用。
研究亮点
通过一种简单方法使用半胱氨酸还原亚硒酸钠合成SeNPs,并引入不同分子量的大豆多肽SP稳定SeNPs
分子量为>10 kDa的SP (SP5)对SeNPs的稳定效果最好
证明了SeNPs通过SP5中的O-和N-基团与SP5结合,主要作用力是氢键和范德华力
SP5-SeNPs具有较高的胆盐结合能力,在新型降血脂剂方面具有应用潜力
研究结论
本文利用不同分子量的大豆多肽SP稳定SeNPs。分子量大于10 kDa的大豆多肽(SP5)对SeNPs具有较好的稳定作用。
稳定性原因分析:由于Cys-SeNPs可以包裹在高分子量的大豆多肽中从而防止分子间聚集,且SP5表面的负电荷增加了SeNPs之间的静电斥力
合成的SP5-SeNPs为无晶态零价球形颗粒,硒含量为31.32±1.34 mg/L。
Cys-SeNPs可能与SP5中的O-和N-基团结合,SP5与Cys-SeNPs之间的缔合力主要是氢键和范德华力。
SP5-SeNPs在体外显示出对胆盐的高结合能力,有作为一种新型降血脂剂的潜力。
图文解析
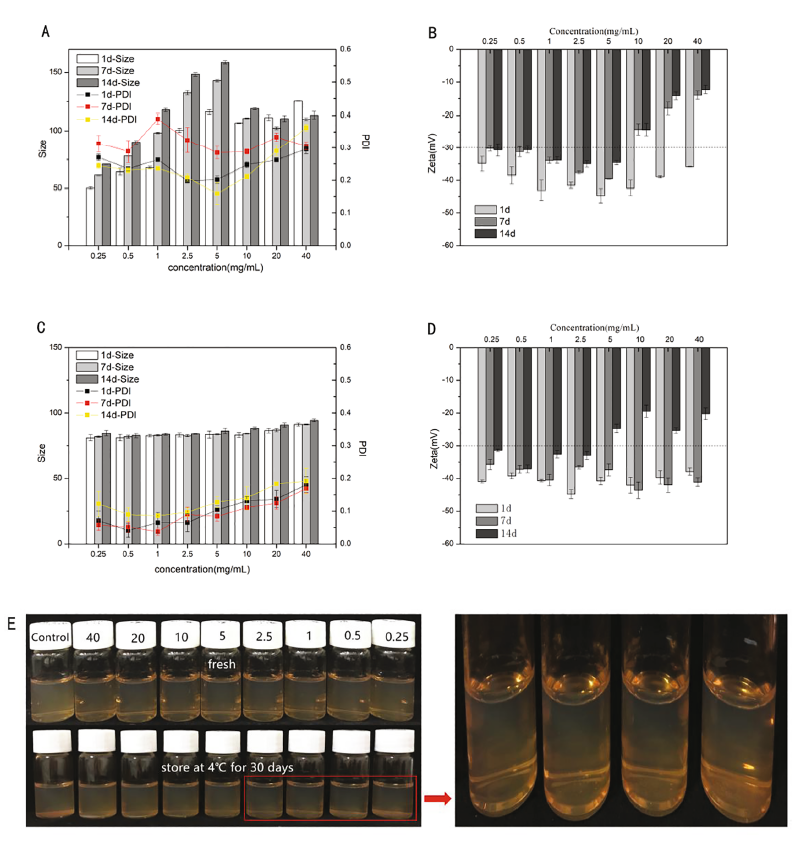
图1. 方法1中SP浓度对合成的SP-SeNPs的粒径、PDI (A)和zeta电位(B)的影响。方法2中SP浓度对合成的SP-SeNPs的粒径、PDI (C)和zeta电位(D)的影响。(E)方法2合成的SP-SeNPs在储存过程中的视觉外观。
图1显示了不同浓度的SP对方法1制备的SP- SeNPs的粒径、PDI和zeta电位的影响。当SP添加量为0.25 mg/mL时,新合成的SP-SeNPs的粒径可小至50 nm。而SP-SeNPs的粒径和PDI随时间变化较大。相比之下,根据方法2合成的SP-SeNPs更加稳定,SP-SeNPs的zeta电位绝对值在添加从0.25 mg/mL到2.5 mg/mL的SP后,在4◦C保存14天后大于30 mV。SP的添加量超过5 mg/mL时,SeNPs的zeta电位绝对值均小于30 mV,表明SeNPs容易聚集。然后将SeNPs在4◦C保存30天,在此期间,对照组(Cys-SeNPs)中观察到大量的红色沉淀,而SP-SeNPs溶液中观察到较少的沉淀。因此,SP的存在对稳定SeNPs起到重要作用,且2.5毫克/毫升的SP制备的SP- SeNPs溶液中无明显的沉淀现象。

图2. 不同分子量的SP合成的SP-SeNPs在室温下保存14天后的(A)粒径、形貌和(B)尺寸分布。不同分子量的SP合成的SP-SeNPs在4◦C保存21天后的(C)粒径,外观和(D)尺寸分布。(G)SP及SP-SeNPs的存储在环境温度(E)或4◦C (F)下的的Zeta电位。
SP-SeNPs在贮存过程中的粒径、形貌、粒径分布和zeta电位的变化如图2所示。在环境温度下,随着储存时间的延长,所有SP-SeNPs的颗粒尺寸都在增大。高分子量大豆多肽在常温下可以更好地稳定Cys-SeNPs。与环境温度相比,所有的SP-SeNPs在4◦C下表现出更好的稳定性,并且在SP5-SeNPs中观察到最小的颗粒尺寸变化。综上,SP5-SeNPs最稳定,说明分子量大于10 kDa的大豆多肽对Cys-SeNPs的稳定作用更好。
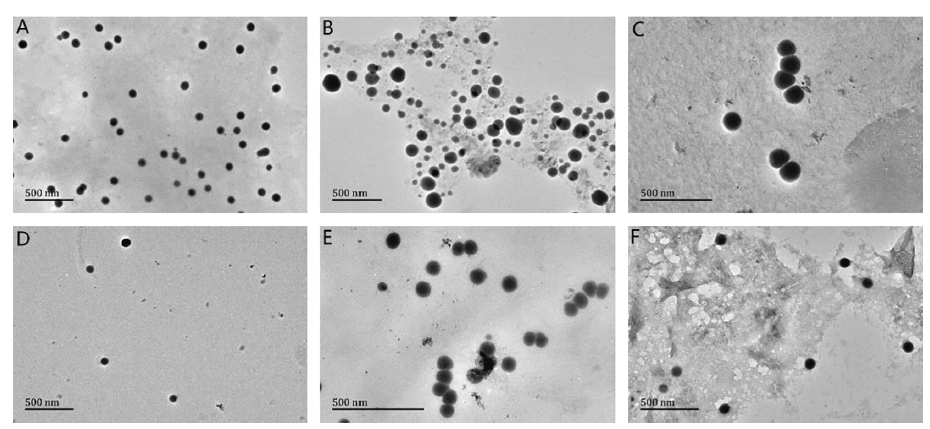
图3. (A) Cys-SeNPs、(B) SP1-SeNPs、(C) SP2-SeNPs、(D) SP3-SeNPs、(E) SP4-SeNPs和(F) SP5-SeNPs的TEM图。
TEM图可揭示SeNPs形状、大小和聚集情况。SP5-SeNPs被大豆多肽(SP5)包裹,其分散性和尺寸均匀性优于其他SeNPs。这可能是SP5-SeNPs在存储过程中比其他SeNPs更稳定的原因之一。SeNPs吸附在大豆多肽(SP1)上的方式与SP5-SeNPs相似,但SP1-SeNPs的颗粒大小由大到小,这可能与SP1中含有不同分子量的成分有关。

图4. (A) Cys, Cys-SeNPs, (B) SP5和SP5- SeNPs的FT-IR光谱。(C) ITC测定中SP5溶液注入Cys-SeNPs溶液时记录的热流。(D)通过对单个热流信号的积分得到的摩尔热值作为ITC测定中混合比的函数。(E)ITC测定中SP5与Cys-SeNPs相互作用的结合和热力学参数。
从SP5和SP5- senps的FT-IR光谱可以看出,两者的光谱显示出几乎相同的吸收峰。这一结果表明,SP5通过分子间相互作用与Cys-SeNPs复合,而不产生新的化学键。Cys-SeNPs的稳定性通过与SP5中含O-和N-基团的相互作用而得到改善。ITC结果证实了氢键和范德华力是SP5和Cys-SeNPs结合的主要驱动力。这可能与SP5和Cys中富含-OH, -NH和-COOH基团有关。

图5. (A) SP5和SP5- SeNPs的XRD谱。(B) SP5-SeNPs的XPS光谱,(C) Se 3d谱和(D) C 1s谱。
XRD及XPS结果证明所制备的SP5-SeNPs为非晶态零价硒纳米颗粒。ICP-OES结果表明,SP5-SeNPs中Se含量为31.32±1.34 mg/L。

图6. (A) SP5-SeNPs对不同浓度胆盐的结合能力。(B) Cys、SP5、Cys-SeNPs和SP5-SeNPs与胆盐的结合能力。
图6的结果表明,SP5-SeNPs可能通过结合胆固醇促进胆固醇的排出而起到降血脂的作用。推测胆盐上的羟基可能通过氢键与SeNPs上的羟基、氨基等官能团相互作用。而SeNPs较高的比表面积为胆盐提供了较大的吸附表面积,这可能在胆盐结合中发挥关键作用。SP5丰富的羟基和氨基以及多孔形态(图3F)可能是SP5对胆汁产生积极作用的原因。
期刊:Food Chemistry (IF 9.231-Q1)
发表日期:2022.5
单位:广州大学化学学院
参考文献:Huang Q, Lin W, Yang X Q, et al. Development, characterization and in vitro bile salts binding capacity of selenium nanoparticles stabilized by soybean polypeptides[J]. Food Chemistry, 2022: 133286.
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942

