磁性分子印迹聚合物用于选择性分离和检测金黄色葡萄球菌
在环境质量控制、临床诊断和食品工业中控制和识别细菌污染是十分重要的。本文检测的致病菌为金黄色葡萄球菌,金黄色葡萄球菌是一种革兰氏阳性兼性厌氧菌,可以从乳腺炎奶牛的乳汁中分离到,可引起严重的感染,症状包括恶心、呕吐、腹泻、全身不适和虚弱,对老年人和年轻人、孕妇和免疫系统受损的人尤其严重,对公众健康构成威胁。在检测方面,已经有多种包括聚合酶链反应(PCR)、培养和菌落计数方法以及基于免疫的方法,包括ELISA等检测方法。然而,这些方法耗时、费力和(或)昂贵,因此,许多研究人员正在寻找快速、敏感检测食品中病原体的新方法。
本文采用了非共价印迹方法,一般来说,分子印迹利用分子模板在交联聚合物中创建选择性结合位点。使用这种方法,可以为目标模板/分析物制备选择性识别材料。分子印迹聚合物(MIPs)与生物大分子(如抗体、酶等)相比具有更高的化学和物理稳定性。此外,MIPs可以大量生产,并且在大多数情况下可以重复使用。此外,本文利用多巴胺制作MIP层,因为多巴胺在碱性条件下能够进行氧化聚合(作为氧化剂),并在多种支撑材料上生成聚多巴胺层,还可以作为功能单体和交联剂,提高了印迹效果,简化了合成。
文中,MIP层被创建在磁颗粒(MPs)的表面。MPs具有较高的磁灵敏度,因此,与目标分子相互作用后,可以很容易地收集并利用外部磁场分离,无需离心或过滤。这意味着磁性颗粒有助于从大量样品中预富集细菌,从而使灵敏的检测成为可能。
模板清洗优化
在印迹材料可以用于应用之前,必须去除模板分子。彻底去除会产生敏感和特定的识别部位,但在清洗过程中,可能会发生一些损坏,如溶剂引起的塌陷或肿胀。因此,有必要找到一种模板移除方法,能够可靠地移除大部分模板,并且不会明显损坏制备的MIPs。在本文的研究中,考虑了三种不同的方法,即3%醋酸(HAc),5% HAc和1% SDS,比例为1:1,最后,裂解溶液。从图1中可以看出,最合适的方法是1:1 5%的HAc和1%的SDS,这样可以去除大部分的模板,并且在接下来的步骤中,可以清楚地看到MIPs仍然具有功能。
以前的研究表明,在洗涤液中SDS的存在,特别是与HAc结合时,增加了非特异性的结合。因此,在检测之前,洗涤液必须完全除去。因此,在本文中,先用5%的HAc和1%的SDS洗涤后,再用MilliQ水洗涤MIPs三次。但是,当裂解液被用来移除模板时,它破坏了聚多巴胺层,使模板变得无法发挥作用。

图 1模板拆除过程的优化
优化非结合和非特定结合分析物的洗涤
另一个重要的步骤是去除非结合和非特异性结合的分析物。特定的相互作用意味着细菌会重新结合到明确的空腔中。这些相互作用应该比任何非特异性的相互作用更强,而非特异性的相互作用很容易被合适的溶剂所打断。溶剂必须除去非特异性结合的分析物以及其他干扰物,但同时不应破坏所需的特异性相互作用。对于非结合和非特异性结合的分析物的去除,本文尝试了三种不同的方法,即采用MilliQ水、3%的HAc和5%的HAc和1%的SDS,比例为1:1。得到的数据如图2所示。可以看到MilliQ水是最合适的(图2A-B)。从NIP的测量值中得到的值表明,MilliQ水可以从MIPs中除去非特异性相互作用。然而,在3% HAc或5% HAc与1% SDS混合的情况下,则无法进行特异性结合。

图 2 优化未结合分析物的去除
MIP的结合能力和吸附动力学
为了评价MIPs的结合特性,比较了不同初始浓度(1 × 106 ~ 1 × 102 CFU·ml−1)的细菌,以确定MIPs对NIPs的结合能力。如图3A所示,细菌在MIPs上的吸附随着细菌浓度的增加而增加。在使用的条件下,即使在细菌浓度最高的情况下,表面也没有达到饱和,因此可以发现本文制备的聚合物表面的结合能力足够高,可以达到预期的目的。
NIPs是在与MIPs相同的条件下制备的,但是不存在模板细菌,并作为非特异性结合的指标:NIPs表面随机排列的功能基团与分析物相互作用,导致非特异性结合。
图3B为细菌在MIPs和NIPs表面的吸附动力学。结合实验在1 × 106 CFU·ml−1条件下进行。随后,将MIPs与NIPs的结合能力进行比较。MIPs表面的荧光强度在前10 min迅速增加,20 min后达到吸附平衡,不再增加。NIPs的荧光强度增加缓慢,6 min后达到平衡。通过对比我们可以看出,MIPs和NIPs的结合能力有较大的差异,且MIPs的结合能力更强。

图 3 MIPs和NIPs对细菌的吸附动力学(A)和等温线(B)
分子印迹聚合物的选择性研究以及牛奶样品中细菌的提取
为了证明选择性,有必要测量MIPs和可能竞争的分析物之间的相互作用。在本文中,选择粪肠球菌作为竞争细菌,因为该细菌是革兰氏阳性细菌,且大小和形状与金黄色葡萄球菌相似(0.5-2µm)。为了证明MIPs对金黄色葡萄球菌的选择性,我们进行了一项结合研究,结果如图4A所示。为金黄色葡萄球菌制备的MIPs具有选择性,仅有少量粪肠球菌与MIPs和NIPs表面结合,且无特异性。
通过在已知浓度(1 × 106 CFU·ml−1)的患有乳腺炎的奶牛的牛奶中选择性分离金黄色葡萄球菌,研究了该方法的保真度,并与从缓冲液中分离得到的值进行了比较。如图4B所示,在牛奶样品中检测金黄色葡萄球菌的效率与在缓冲悬液中相同。
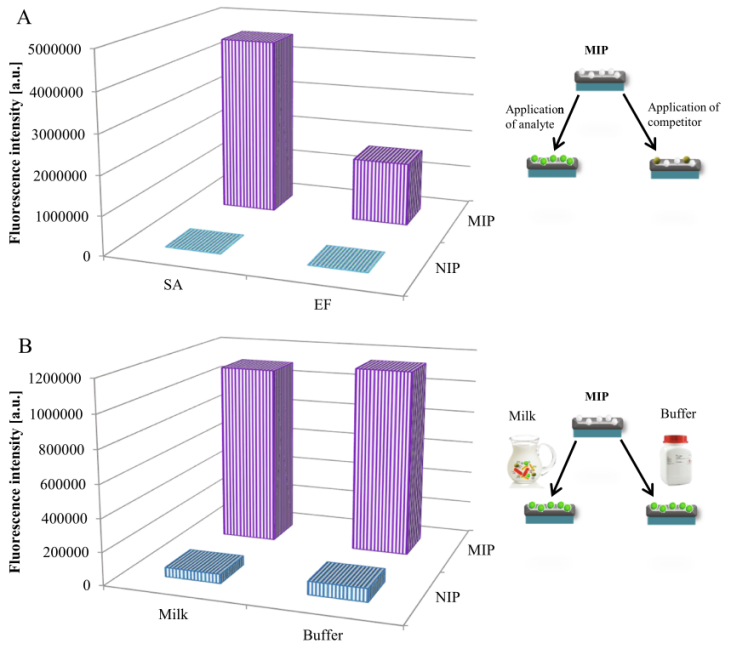
图 4 A)MIP选择性图。金黄色葡萄球菌(SA)被用作MIP制备的模板,粪肠球菌(EF)被用作竞争对手。B)不同基质(牛奶和缓冲液)SA分离效率的比较。
磁性分子印迹聚合物
本文的方法进一步验证了来自当地超市的样本,来自一头乳腺炎奶牛的生奶,以及来自健康奶牛的牛奶。得到的结果如图5A-H所示。验证了该方法的适用性,并在模型和加标的真实样品中检测到金黄色葡萄球菌。在该方法的检测限(1 × 103 CFU·ml−1)下,超市样品或健康奶牛的牛奶中含有金黄色葡萄球菌。
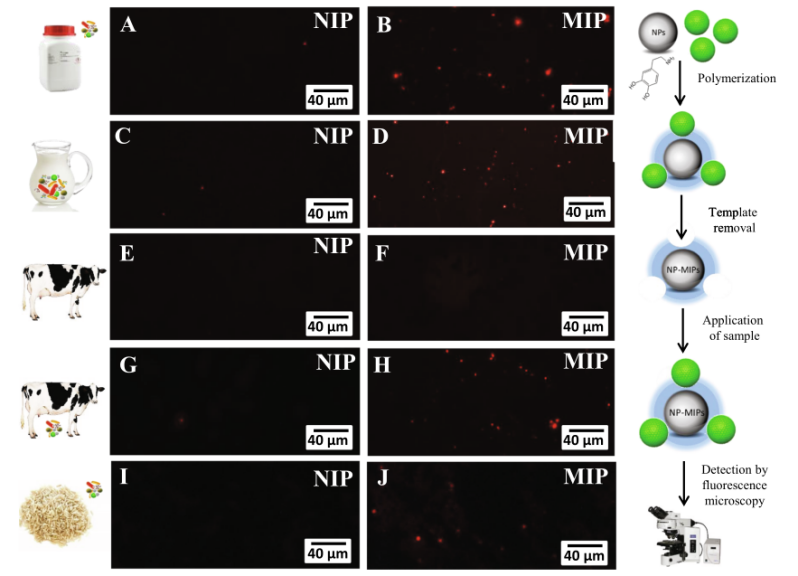
图 5 磁性颗粒表面聚多巴胺MIP荧光显微镜检测金黄色葡萄球菌
此外,使用添加金黄色葡萄球菌的煮熟大米对非液体食品样品进行分析(图5I和J)。根据得到的数据,可以对所有样品进行定量分析,如图6所示。根据校准图,最多可确定5700 CFU·ml−1,这与之前的研究一致,并通过琼脂上的细菌培养得到验证(如图6A-E的插图所示)。结果表明,该方法可检测出1 × 103 CFU·ml−1的金黄色葡萄球菌。
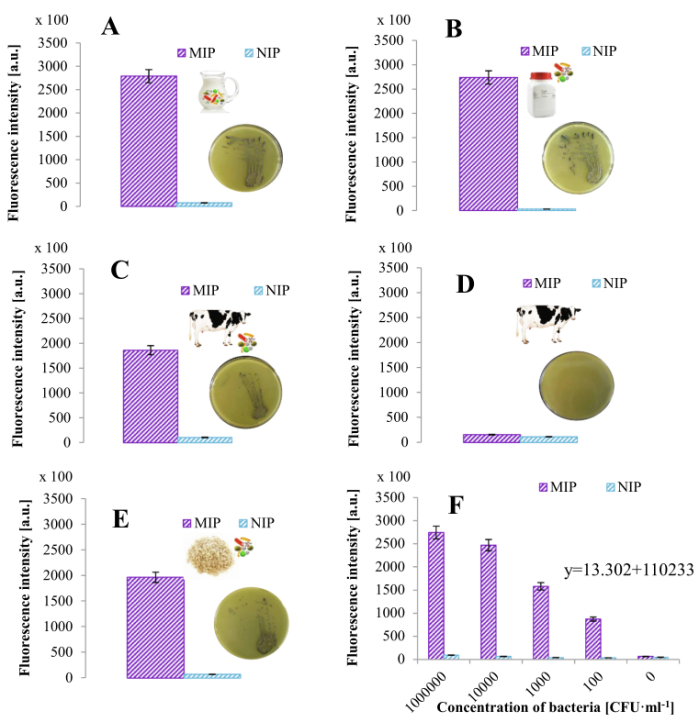
图 6 实际样品分析的荧光定量
结论:以多巴胺为功能单体,通过非共价分子印迹技术开发了金黄色葡萄球菌选择性MIPs,并对其识别能力进行了评价。得到的印迹聚合物在最佳吸附条件下具有快速的吸附动力学、良好的吸附性能和较高的选择性。采用这种新方法,牛奶中细菌的检测浓度为1 × 103 CFU·ml−1,符合欧盟食品微生物控制法规规定的限度。该方法简单、快速、环保、专属性强,且与其他方法相比,生产成本低。因此,该方法的实施有助于降低细菌检测的成本,并可能适用于医药或食品行业。
参考文献:Bezdekova J, Zemankova K, Hutarova J, Kociova S, Smerkova K, Adam V, Vaculovicova M. Magnetic molecularly imprinted polymers used for selective isolation and detection of Staphylococcus aureus. Food Chem. 2020 Aug 15;321:126673. doi: 10.1016/j.foodchem.2020.126673. Epub 2020 Mar 23. PMID: 32278983.
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942

