人类的福音来啦,癌症治疗新方案!
在临床癌症治疗中应用的多模式疗法是将两种或两种以上的治疗方法以协同的方式结合起来,有望克服单一疗法固有的缺点,提高抗癌疗效协同治疗针对多个关键途径,具有可加性,可潜在地克服耐药,减少药物用量,避免潜在的系统性副作用。在过去的十年中,化学动力疗法(CDT)可以诱导肿瘤细胞中的活性氧(ROS),打破细胞内氧化还原/氧化状态的平衡广泛调查。原则上,CDT是由芬顿反应驱动的。该试剂通过Fe2+/ Fe3+氧化还原对催化细胞内的H2O2产生剧毒ROS。羟基自由基(•OH)比其他类型的ROS,如单线态氧(1O2),具有更强的氧化能力,对生物分子和细胞器造成严重的氧化损伤同时,能够维持氧化还原稳态的正常细胞可在一定程度上避免ROS的损伤因此,CDT被认为对癌细胞有特定的抑制作用,同时抑制对周围组织的副作用。
摘要:化学动力疗法(CDT)具有选择性治疗效果和低副作用的特点,近年来受到越来越多的关注。然而,肿瘤部位细胞内H2O2和酸的含量有限,抑制了芬顿反应的持续,从而抑制了CDT的抗癌效果。本研究合成了一种具有高芬顿活性的纳米级co -二茂铁金属-有机骨架(Co-Fc NMOF),并与葡萄糖氧化酶(GOx)结合,构建了一个级联酶/芬顿催化平台(Co-Fc@GOx),用于增强肿瘤治疗。在该体系中,Co-Fc NMOF不仅可以作为一种多功能且有效的GOx分子运输载体来调节反应条件,而且对于产生剧毒•OH具有良好的芬顿效应。在肿瘤微环境中,Co-Fc NMOF传递的GOx催化内源性葡萄糖生成葡萄糖酸和H2O2.从而促进细胞内酸性和H2O2含量,进而有利于Co-Fc NMOF的芬顿反应,促进活性氧(ROS)的产生。体外和体内实验结果表明,Co-Fc@GOx纳米酶引发的级联酶促/芬顿催化反应具有显著的抗癌性能。
Co-Fc@GOx作为级联酶促/芬顿反应平台促进•OH诱导的示意图
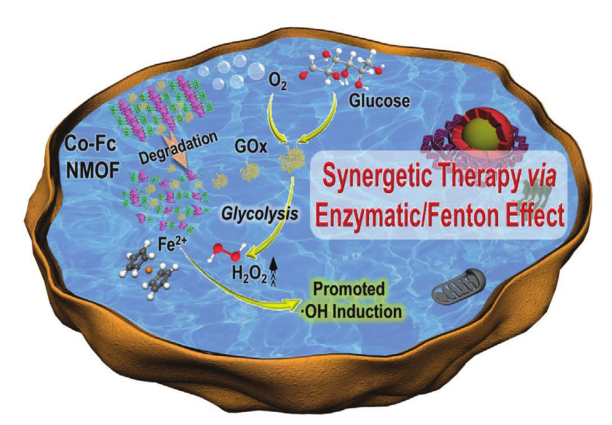

如上图所示,本研究中首次合成了一种Co-Fc NMOF,与GOx分子结合(Co-Fc@GOx),用于促进CDT。用二茂铁作为有机配体构建的Co-Fc NMOF作为GOx分子的芬顿剂和运输货物。由于Fe2+的存在,制备的Co-Fc NMOF不仅具有较高的Fenton活性,而且具有良好的微观结构特征,有利于结合功能蛋白分子。释放的GOx被癌细胞中过量的葡萄糖激活,产生大量的葡萄糖酸和H2O2.上调的细胞内酸性和H2O2极大地促进了芬顿反应,放大了细胞毒性羟基自由基(•OH)的原位诱导,进而增强了对癌细胞的抑制作用。构建的Co-Fc@GOx平台在葡萄糖/氧气消耗和H2O2/酸/•OH生成方面表现出相当高的效率,使CDT在体外和体内的功效都得到了放大。研究结果表明,这种新型的gox功能化co基NMOF具有仿生纳米酶的功能,可能成为促进肿瘤治疗的替代CDT平台。
Co-Fc@GOx纳米材料性能表征示意图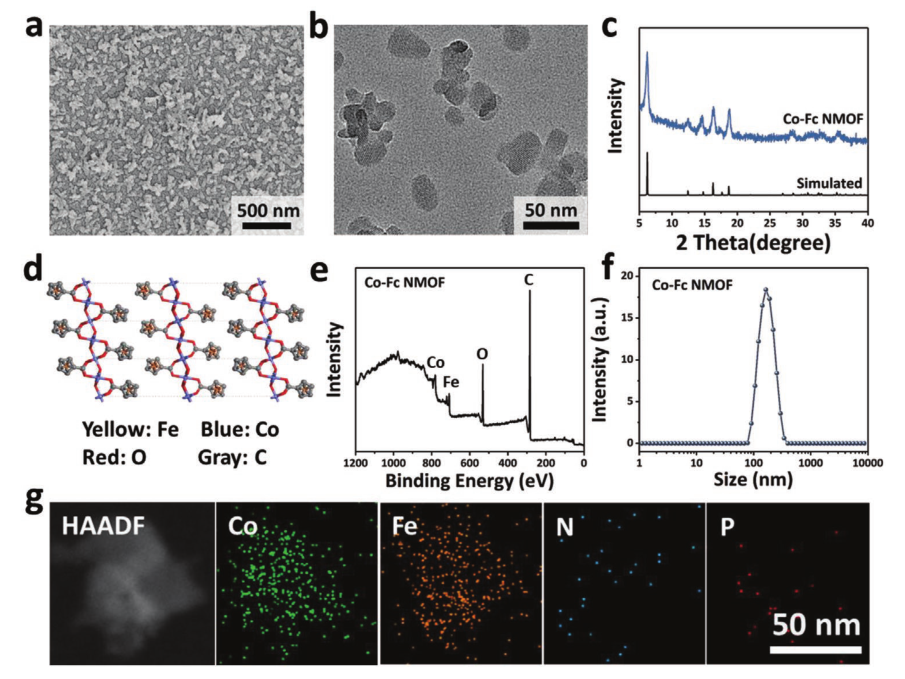

图a为SEM图,图b为TEM图,其中Co-Fc NMOF的尺寸约为80 nm(图a,b),加入了PVP来调节晶体生长。图c为x射线衍射模式图,x射线衍射(XRD)图谱证实Co-Fc NMOF与报道的Zn-Fc MOF具有等结构(图c)。图d为晶体结构图,Co-Fc NMOF分别以Co(OAc)2·4H2O和Fc(COOH)2为金属源和有机配体合成,结构如图d所示。图e和f为XPS,水动力直径≈184 nm,略大于Co-Fc NMOF。此外,Co-Fc和Co-Fc@GOx的zeta电位分别为-15.5和16.5 mV,表明GOx分子通过物理吸附加载。图g为Co-Fc@GOx的EDS元素映射,与Co-Fc NMOF相比,Co-Fc@GOx出现了额外的磷(P)元素,这是由于GOx分子的装载所致。
OH初始生成速度与H2O2浓度的Michaelis-Menten的条件优化示意图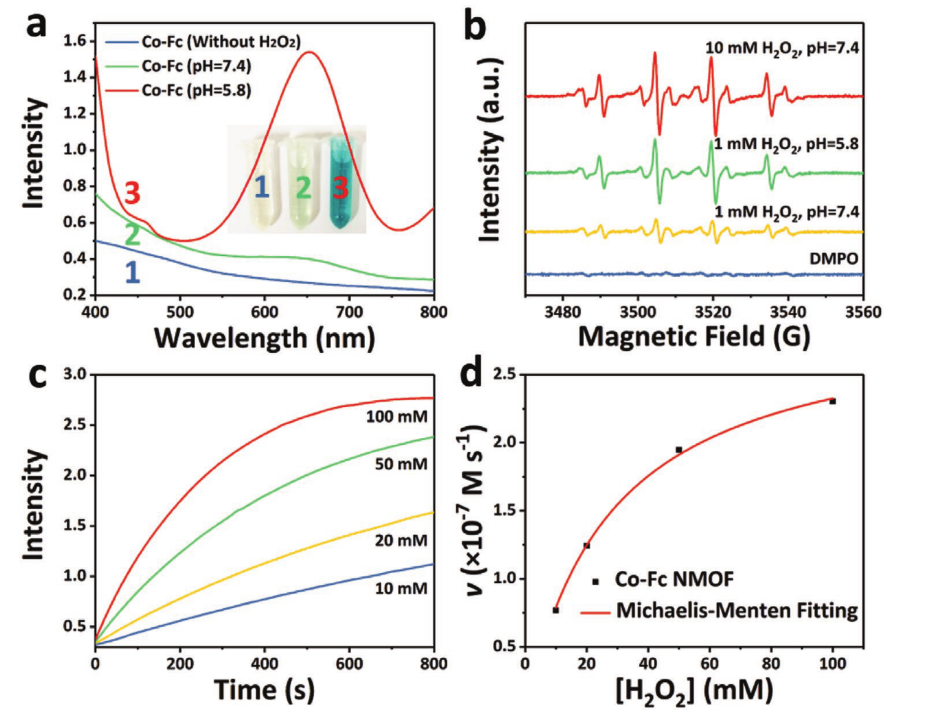

图a为添加1)100µg mL Co-Fc NMOF, pH = 7.4. 2) 100µg mL-1 Co-Fc NMOF, 100 × 10-3 m H2O2. pH = 7.4. 3) 100µg mL-1 Co-Fc NMOF, 100 × 10-3 m H2O2. pH = 5.8时TMB溶液的紫外可见吸收光谱。图b为在不同条件下,添加100µg mL−1 Co-Fc NMOF获得ESR谱。图c是在0.8 × 10−3 m TMB (pH = 5.8)条件下,不同H2O2浓度(10、20、50和100 × 10−3 m)在652 nm处的时程吸光度。图d为•OH初始生成速度与H2O2浓度的Michaelis-Menten拟合曲线。
反应过程各项指标变化示意图
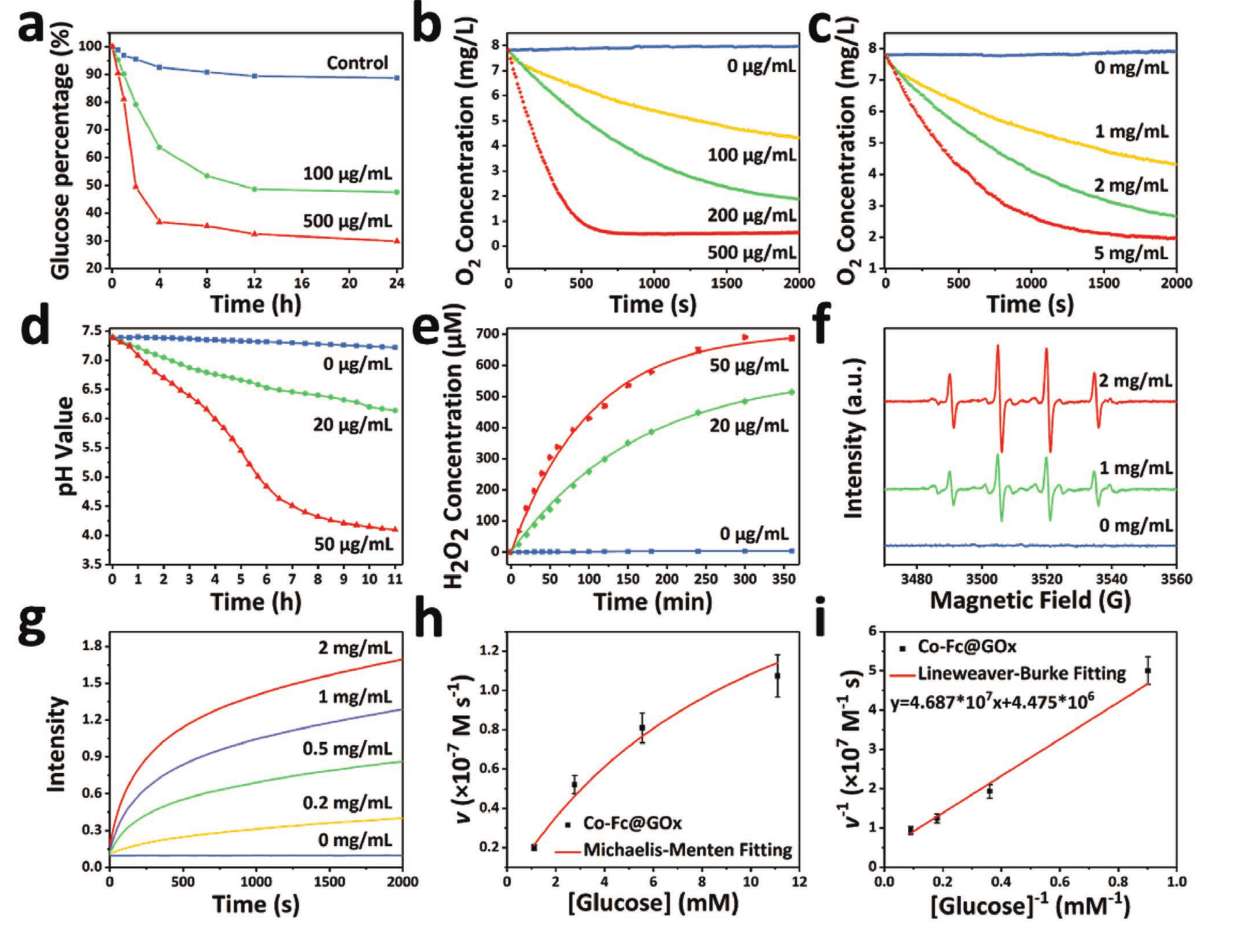

为了评价GOx (Co-Fc@GOx)加载后的级联催化效果,应用葡萄糖启动糖酵解过程。研究了葡萄糖和溶解氧的浓度变化。图a葡萄糖和b葡萄糖溶液(1 mg mL−1)的O2浓度的变化,添加0、100、200和500µg mL−1 Co-Fc@GOx。图c为不同葡萄糖溶液(0、1、2、5 mg mL−1)的O2浓度不同,添加100µg mL−1 Co-Fc@GOx。图d pH值和e葡萄糖溶液(1 mg mL−1)中H2O2浓度的变化,添加0、20、50µg mL−1 Co-Fc@GOx。图f在不同浓度的葡萄糖溶液(0、1、2 mg mL−1)中添加100µg mL−1 Co-Fc@GOx获得的ESR光谱。图g在0.8 × 10−3 m TMB条件下,不同葡萄糖浓度(0、0.2、0.5、1和2 mg mL−1)在652 nm处的时程吸光度。图h•OH初始生成速度与葡萄糖浓度的Michaelis-Menten拟合曲线。图i Michaelis-Menten拟合曲线的Lineweaver-Burk拟合(双倒数)。
PBS、Co-Fc NMOF和Co-Fc@GOx孵育的4T1细胞增殖情况示意图
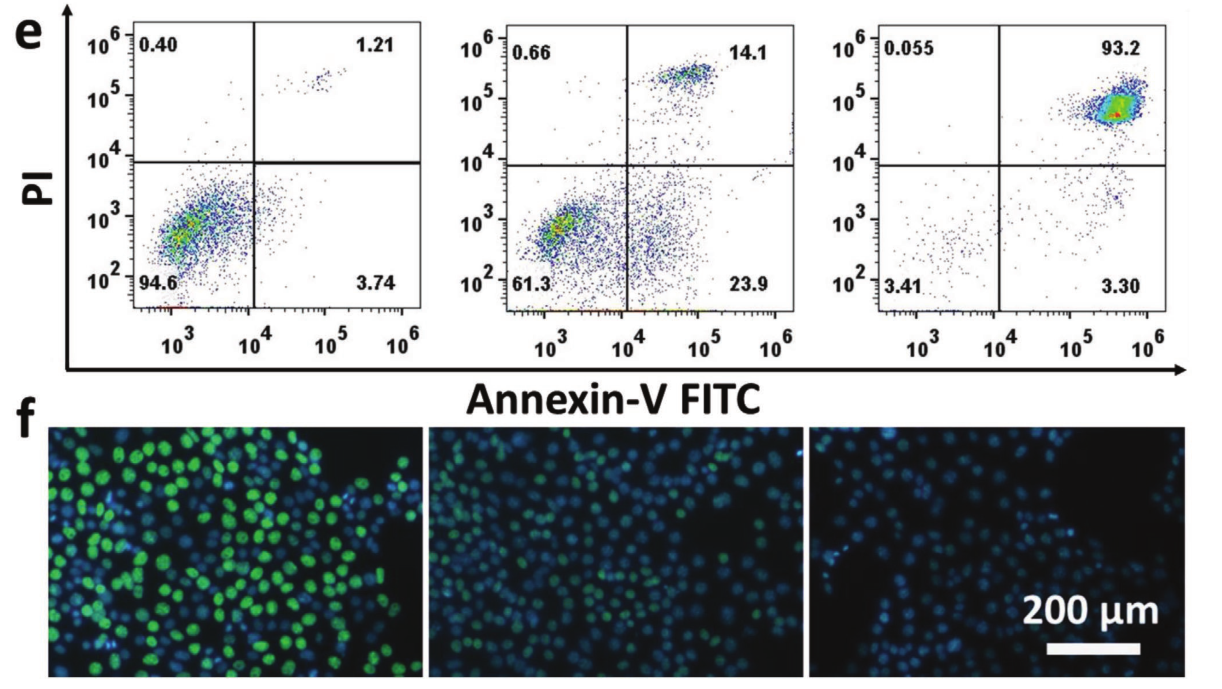


图a为不同浓度(0 ~ 100µg mL−1)Co-Fc NMOF的HUVEC细胞活力。图b是添加或不添加200 × 10−6 m H2O2时Co-Fc NMOF的4T1细胞存活率。图c在RPMI 1640培养基(葡萄糖含量:2 mg mL−1)中,用Co-Fc NMOF、0.5%和1% GOx加载Co-Fc@GOx培养4T1肿瘤细胞的细胞存活率。 图d PBS、Co-Fc NMOF和Co-Fc@GOx孵育的4T1细胞,钙黄素AM和PI共染后合并荧光图像。图e流式细胞术分析细胞凋亡图f EdU染色(Merge)观察PBS、Co-Fc NMOF和Co-Fc@GOx孵育的4T1细胞增殖情况。(***p < 0.001. **p < 0.01.或*p < 0.05)。
Co-Fc@GOx作为级联酶/催化平台促进细胞内•OH诱导的作用机制示意图
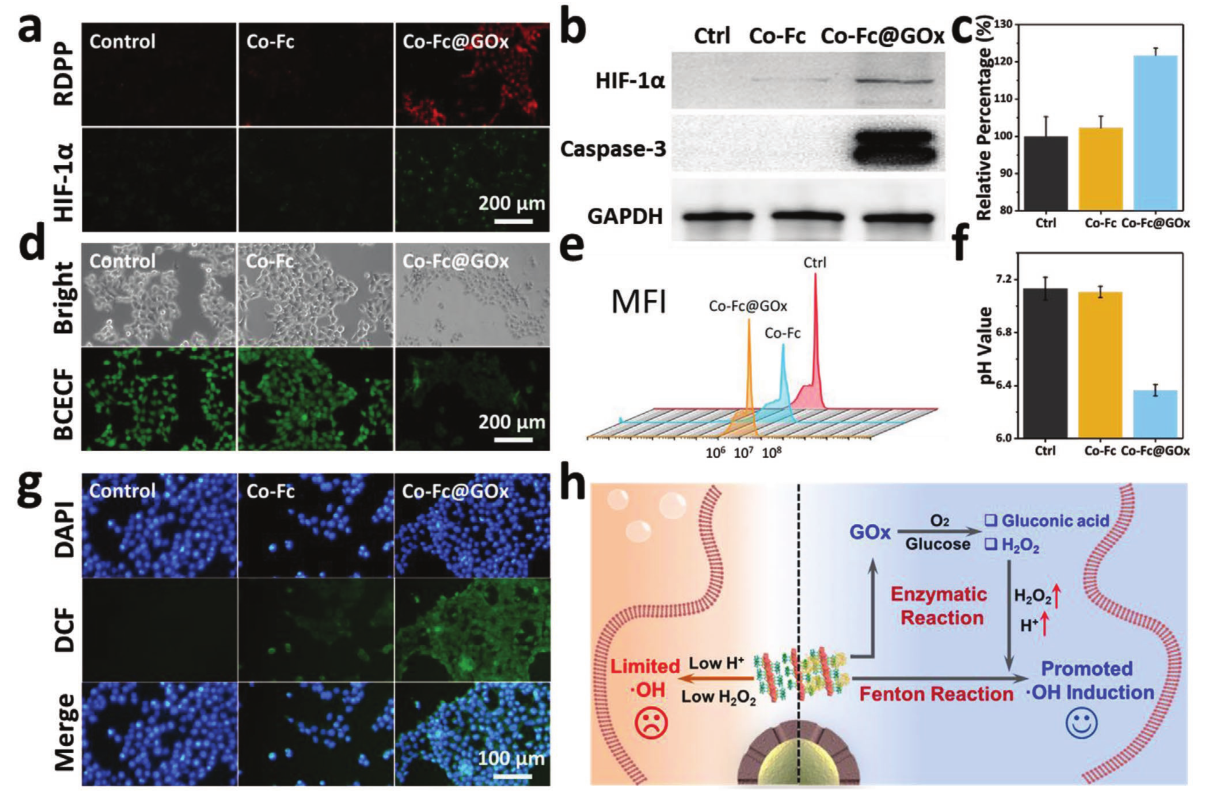

图a 4T1细胞经PBS、Co-Fc NMOF、Co-Fc@GOx等RDPP染色后的荧光图像和HIF-1α表达的免疫荧光图像。图b Western blot检测PBS、Co-Fc NMOF和Co-Fc@GOx处理的4T1细胞中HIF-1α和caspase-3的表达。图c为过氧化氢检测试剂盒检测PBS、Co-Fc NMOF和Co-Fc@GOx孵育8 h后的4T1细胞的细胞内H2O2.图d是 PBS、Co-Fc NMOF和Co-Fc@GOx孵育4T1细胞,BCECF-AM染色检测pH值后的亮场和荧光图像。图e为 PBS、Co-Fc NMOF和Co-Fc@GOx孵育4T1细胞的平均荧光强度和图f是 pH值,用流式细胞仪量化并绘制标准曲线。图g是 PBS、Co-Fc NMOF和Co-Fc@GOx孵育后DCFH-DA染色检测ROS的4T1细胞荧光图像。图h是 Co-Fc@GOx作为级联酶/催化平台促进细胞内•OH诱导的作用机制示意图。
体内抗癌研究
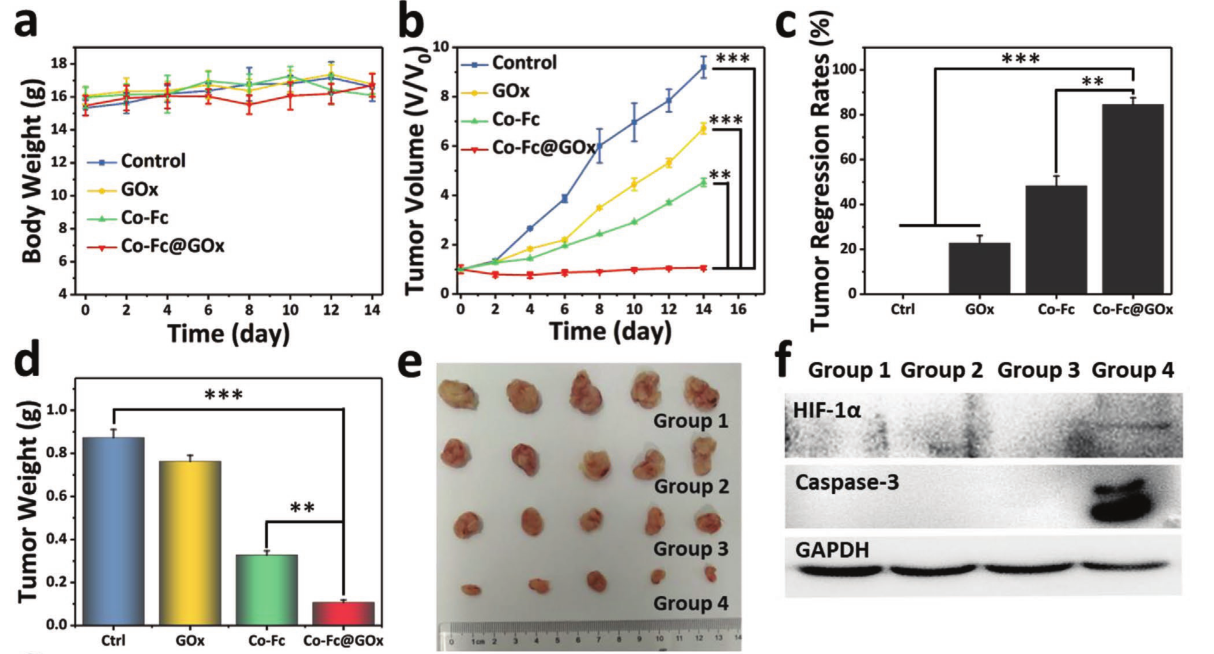


图a小鼠体重和图b随后14天的肿瘤体积变化。图c 14 d后各组小鼠的幽默消退率。图d肿瘤重量和图e 14天后从不同组小鼠身上采集的肿瘤照片。图f不同组的Western blot分析。图g不同组H&E、Ki67、HIF-1α染色肿瘤切片(标尺:H&E, 100µm;Ki67和HIF-1α: 50 μ m)。(***p < 0.001. **p < 0.01.或*p < 0.05)。
总结:
本研究首次成功合成了纳米级的共二茂铁MOF,并结合GOx构建了级联纳米酶。Co-Fc@GOx为促进化疗提供了独特的级联酶/芬顿效应。在该平台中,Co-Fc NMOF表现出独特的芬顿活性,其主要来源于含Fe2+的二茂铁。此外,Co-Fc NMOF在胞内传递的GOx分子可以启动糖酵解,催化葡萄糖产生大量的葡萄糖酸和H2O2.在酸性条件下,Co-Fc NMOF通过Fenton反应有效催化生成H2O2.诱导高氧化•OH。体外和体内研究表明,Co-Fc@GOx在细胞内通过触发级联酶/ Fenton反应,具有显著的抑制癌细胞和肿瘤消退的能力。因此,本研究为协同治疗癌症提供了另一种有效调节肿瘤微环境的潜在治疗平台。
参考文献:
Chao Fang, Zheng Deng, Guodong Cao, Qiang Chu, Yulian Wu, Xiang Li, Xinsheng Peng, and Gaorong Han. Co–Ferrocene MOF/Glucose Oxidase as Cascade Nanozyme for Effective T umor Therapy. Adv. Funct. Mater. 2020. 1910085.
DOI:10.1002/adfm.201910085
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942

