一种具有应用潜力的广谱抗菌细胞壁蛋白水解酶
噬菌体疗法可能是克服抗生素危机的有效解决方案。这是由于噬菌体的可用性、选择性杀伤能力和低毒性,以及与抗生素的协同作用。然而,由于担心使用"活病毒"可能不为一般人群所接受,因为这一概念可能引起人们的焦虑,导致这种治疗很难大规模的应用。噬菌体产生的杀菌蛋白可能是噬菌体和化学抗生素的有价值的替代品。内溶素是噬菌体衍生的酶,在裂解过程中,通过分解细菌细胞壁的肽聚糖(PG)成分,帮助噬菌体颗粒从细菌宿主释。内溶素是最有前途的噬菌体衍生蛋白之一,可用于对抗细菌感染。与噬菌体相比,内溶素的另一个优势是宿主范围更广,而与化学抗生素相比,内溶素仍然表现出较窄的活性谱,从而使宿主的微生物菌群保持完整。到目前为止,还没有报道对内溶素的抗性。在过去的几年中,内溶素作为一种治疗药物在临床上受到了广泛的关注。多项临床研究表明,内溶素对多重耐药菌引起的细菌感染具有一定的清除作用。
在本研究中,作者对来自肠杆菌噬菌体myPSH1140的溶菌酶黏蛋白水解酶(內溶素)Gp105进行了体外表达并对其进行了表征。此内溶素对包括阴沟肠杆菌、肺炎克雷伯菌、铜绿假单胞菌、黏质沙门氏菌、柠檬酸杆菌和鲍曼不动杆菌在内的革兰阴性病原体具有较强的抗菌活性。此外,体外肽聚糖水解实验显示对纯化的肽聚糖具有较强的活性。表明Gp105具有作为抗革兰阴性菌抗菌蛋白的潜力。
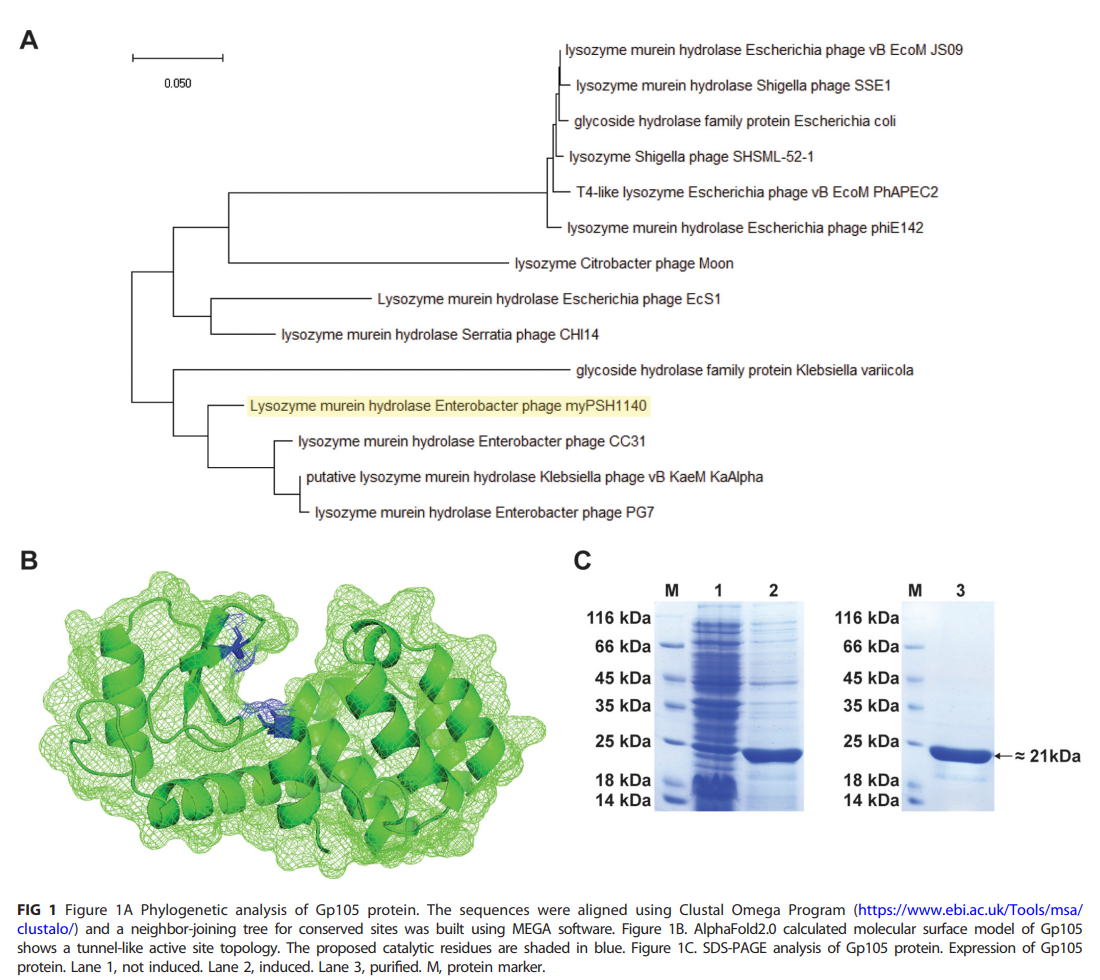
首先作者对其进行分析,系统发育分析显示,myPSH1140的基因组与肠杆菌噬菌体CC31和PG7的相似性分别为90%和92%(图1A)。进一步使用AlphaFold2.0来获得结构模型(图1B)。预测的结构显示了关键催化残基Glu11和Asp20在一个钳状结构中的位置,残基相互面对,允许酶在沿着聚合物网络滑动时“抓住”肽聚糖并水解它。体外表达此蛋白,获得分子量为21 kD的N端his标签蛋白(图1C)。
进一步的测定内溶素Gp105对革兰氏阳性菌和阴性菌的肽聚糖水解特异性,发现其可裂解多种革兰氏阴性菌的肽聚糖。
内溶素Gp105可以抑制革兰氏阴性菌的生长:
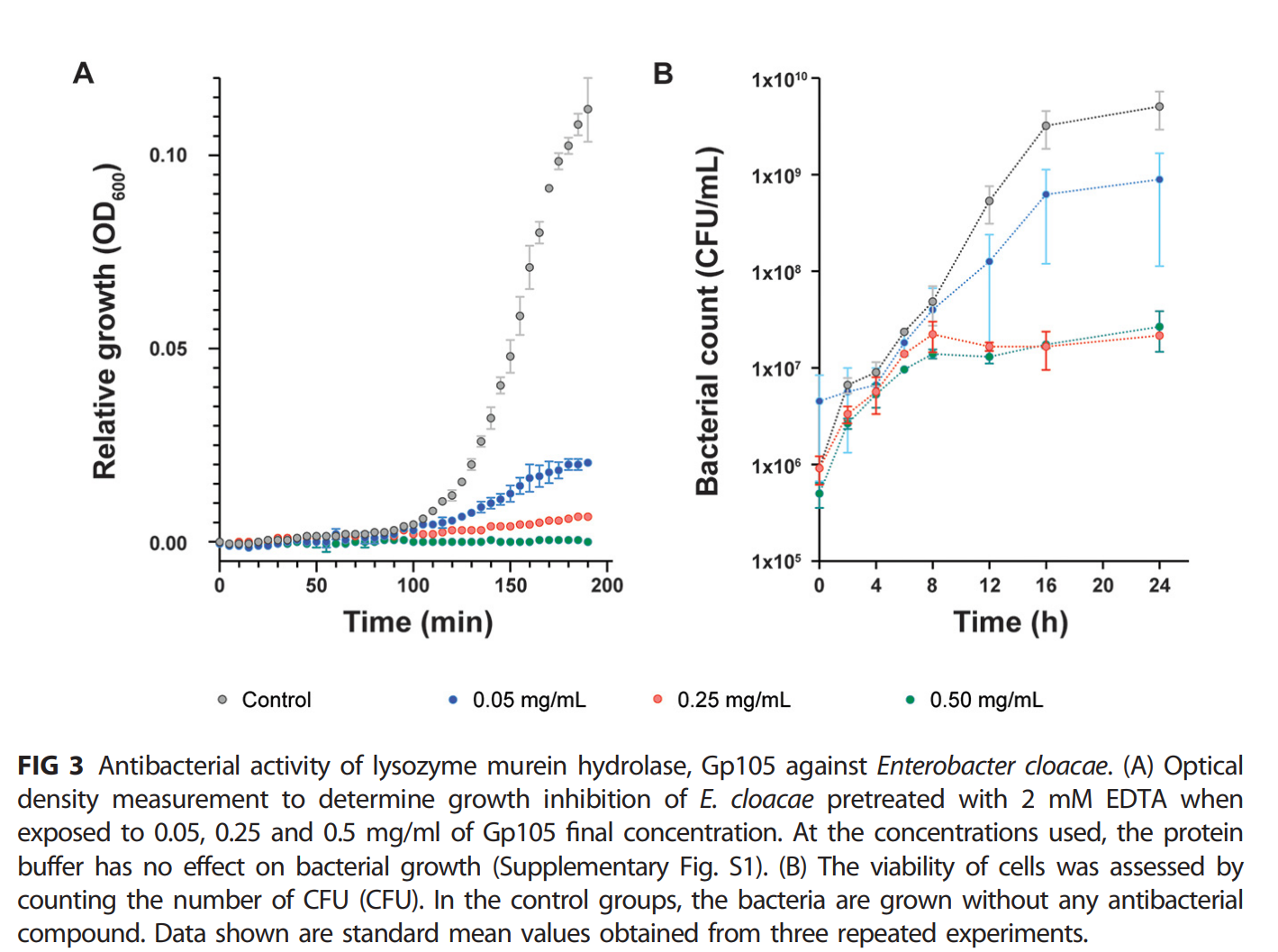
通过测定600 nm处的光密度来测量细菌生长时,在加入0.25和0.5 mg/mL Gp105后5分钟内观察到细菌生长显著减少(图3A)。在不同时间点进行菌落计数,均可获得活菌。然而,随着时间的推移,这一数字并未出现任何显著增加(图3B)。
原文章链接:https://doi.org/10.1128/aac.00506-22
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942

