清除cccDNA以治愈乙型肝炎病毒感染
目前的慢性乙型肝炎治疗策略可以有效地抑制HBV复制,但是很少实现以血清乙型肝炎表面抗原(HBsAg)消失为定义的功能性治愈(我国称之为临床治愈),以至于大多数接受核苷(酸)类似物(NAs)治疗的患者需要长期甚至终生服药。因为患者肝脏内的以微小染色体形式存在的共价闭合环状DNA(cccDNA)的长期存在,在HBsAg清除之前停药常常带来复发。乙肝治愈的主要障碍包括(1)被感染的肝细胞长期带有cccDNA和/或整合的病毒序列,(2)机体对HBV的固有和适应性免疫应答被削弱。
游离的cccDNA位于肝细胞核中,是包括前基因组RNA(pgRNA)在内的所有HBV RNA的转录模板,其中pgRNA是逆转录形成子代病毒HBV rcDNA的模板。cccDNA不仅来源于从头感染的病毒颗粒,还来源于核衣壳新合成rcDNA的细胞内补充。cccDNA的这种双重来源和较长的半衰期解释了为何经过多年的NAs治疗,cccDNA水平的降低依然非常有限。彻底清除或转录沉默cccDNA是阻止病毒再激活的关键,因此cccDNA被认为是治愈乙肝的终极目标。最近,罗氏公司Wang(王丽)等人筛选出了第一个能够减少慢性感染肝细胞中cccDNA的小分子,或为乙肝的治愈提供了新的机遇。此外,还有不少的研究致力于cccDNA定量的标准化,以评估新兴治疗策略的效果。
在病毒通过牛磺胆酸钠共转运多肽(NTCP)受体内化进入细胞后,HBV将其3.2 kb的松弛环状(rc)DNA基因组递送进入宿主细胞核。接着,rcDNA在众多核酶的参与下,被修复形成双链完整的cccDNA(图1)。由于NAs并不靶向rcDNA向cccDNA转化的过程,也不能完全抑制病毒DNA的生成,因此即使在有效的NAs治疗下,cccDNA也会通过从头感染和内循环得到补充。cccDNA的动态变化受被感染细胞的死亡和由此产生的肝细胞更新影响,这可能导致cccDNA清除,前提是新的病毒颗粒没有产生或被抗体中和(注:对于长期NAs治疗带来cccDNA耗竭好的一面是,我们实验室曾通过一系列的实验证实,在逆转录形成子代病毒副链及互补正链的合成过程中,NAs的竞争性掺入将不可逆地终止病毒DNA链的延伸,使“子代病毒”不具有感染性)。cccDNA与核心组蛋白缠绕,并与病毒衣壳蛋白、HBx蛋白以及宿主转录因子结合,形成高度稳定的微小染色体结构。cccDNA的染色质化包括组蛋白沉积和再循环以及表观调控,其机制和动力学尚不明确。rcDNA修复为cccDNA和组蛋白沉积的过程与宿主染色体所经历的步骤相关。由于组蛋白修饰、染色质重塑和转录因子的综合作用,cccDNA受组蛋白编码调控。
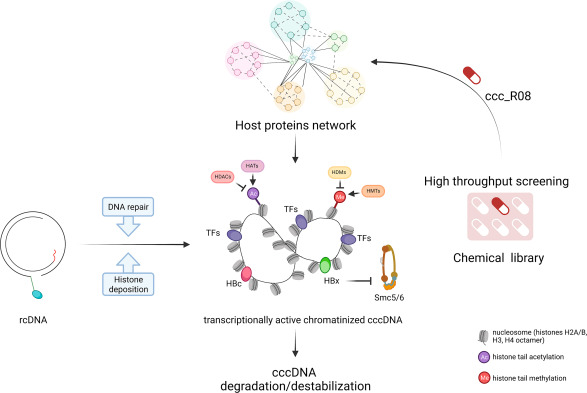
图1 HBV cccDNA形成和染色质化的主要步骤,以及ccc_RO8如何通过宿主蛋白网络的调节对已建立的cccDNA池发挥作用。rcDNA,松弛环状DNA;HDACs,组蛋白脱乙酰酶;HAT,组蛋白乙酰转移酶;HDM,组蛋白去甲基化酶;HMTs,组蛋白甲基转移酶
除了通过特异性免疫介导杀伤等方式清除被感染的肝细胞,直接靶向cccDNA一直是开发HBV治疗药物的挑战。通过了解参与cccDNA形成的宿主因子和机制,可以发现抑制cccDNA生成的新靶点。已有研究表明,多种靶向修复因子的小分子抑制剂可以减少cccDNA,包括:aphidicolin(衍生自细胞周期蛋白依赖性激酶抑制剂p21)、FEN-1核酸内切酶抑制剂PTPD、拓扑异构酶抑制剂、DNA连接酶抑制剂,以及DNA检查点激酶ATR和CHK1抑制剂。以宿主DNA修复途径为靶点的方法在治疗慢性HBV感染方面是否可行和安全还需要进一步研究。此外,阻断rcDNA向cccDNA的转化是否会导致已建立的cccDNA池显著减少还有待观察。因此,靶向已形成的cccDNA池进行降解或沉默其转录/表达,已成为多项研究的主题。研究表明,干扰素α(IFN-α)和淋巴毒素β受体(LTBR)激动剂可上调HBV感染的HepaRG细胞和PHH中的载脂蛋白B mRNA编辑酶3(APOBEC3),导致cccDNA的非细胞溶解性清除。APOBEC3家族成员识别外来DNA并使其脱氨基,从而破坏HBV DNA,并可能导致cccDNA脱氨基。然而,其他研究表明APOBEC优先靶向单链DNA和rcDNA。有体外感染肝细胞的研究表明,IFN-α处理不会导致APOBEC对cccDNA的脱氨基作用,病毒的G-A超突变独立于IFN-α发生。因此,虽然已经证明APOBEC抑制HBV,但APOBEC是否直接靶向cccDNA仍存在争议。
由于cccDNA转录受到宿主细胞表观遗传机制的调节,通过诱导cccDNA的表观遗传沉默来抑制其转录是实现功能性治愈的潜在方法。研究结果显示,IFN-α处理可能会通过影响cccDNA相关组蛋白的翻译后修饰和转录抑制因子的招募来降低其转录活性。IL-6及IL-1β等促炎细胞因子可影响cccDNA的转录活性,但是不会对其水平造成影响。cccDNA相关组蛋白可以直接靶向沉默其转录,有研究证明干扰组蛋白乙酰化或甲基化的药物可抑制cccDNA转录。尽管表观遗传修饰可抑制病毒表达,但是也存在干扰宿主基因调控的风险。HBx在cccDNA转录及病毒感染建立中的作用为寻找沉默cccDNA的病毒特异性靶标提供了新的研究方向。靶向HBx mRNA的siRNA可降低其表达水平,恢复Smc5/6复合物的水平。同时,siRNA和peg-IFNα联合使用可显著降低所有病毒转录本的表达,包括HBx蛋白水平,导致体内Smc6水平出现反弹。此外,靶向HBx-DDB1相互作用的小分子硝唑尼特(NTZ)和Pevonedistat(MLN4924)可在体外HBV感染细胞模型中显著恢复Smc5/6的蛋白水平,抑制cccDNA转录和病毒蛋白合成。
鉴于cccDNA生物学的复杂性及其在病毒感染持久性中的关键作用,通过口服抗病毒药物耗竭肝细胞内的cccDNA库将改变HBV治愈的前景。Wang等人通过在HBV感染的原代人肝细胞和HepDES19细胞中进行高通量筛选发现了一种可降低cccDNA水平的小分子ccc_R08,并在环状HBV(HBV circle)小鼠模型及人肝嵌合小鼠模型中进行了验证。ccc_R08可降低小鼠血清中的HBsAg、HBeAg、HBV DNA、pgRNA及肝细胞中的cccDNA水平,这是首次发现有小分子可作用于已建立的cccDNA库。
尽管作者将这种小分子称为cccDNA“抑制剂”,但是该化合物的具体作用机制还有待探究,比如是否可能与参与cccDNA降解或诱导其稳定性降低的细胞过程有关(图1)。值得注意的是, ccc_R08治疗可显著降低病毒转录本,并影响宿主基因表达。在这项研究所使用的模型中,HBsAg主要来源于有转录活性的cccDNA,整合来源可以忽略不计。结果显示,cccDNA水平降低的幅度要小于HBsAg的降幅,提示该化合物可能会优先破坏具有转录活性的cccDNA的稳定性。因此,关于cccDNA的染色质结构是否会影响其对ccc_R08治疗的敏感性值得进一步探究。宿主转录组学和病毒复制及RNA表达的综合分析显示,ccc_R08的抗病毒作用可能与宿主基因调控网格有关。为了克服在敲低和敲除上遇到的困难,作者使用了一种巧妙的正向和反向药理学的方法,确定了两个可能参与ccc_R08药理作用的基因列表,并鉴定了可能的靶位点,包括CHEK1、CHEK2、TOP2A和ATM13(注:多与细胞DNA损伤的识别与修复有关)。未来还应继续探索新的候选药物,包括转录因子、治疗性蛋白和信号转导蛋白等。对这些候选药物的功能研究可能会为鉴定cccDNA相关的分子靶标开辟新的方向。
总之,Wang等人的这项研究不仅为寻找清除cccDNA的新药提供了希望,还为探究参与HBV微染色体形成及持久性的细胞调节网络提供了新的基础。
参考文献:Zoulim F, Testoni B. Eliminating cccDNA to cure Hepatitis B virus (HBV) infection [published online ahead of print, 2023 Jan 27]. J Hepatol.2023;S0168-8278(23)00029-6. doi:10.1016/j.jhep.2023.01.017
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942

