发现胃癌细胞免疫逃逸机制和潜在生物标志物
4月8日,中山大学李焱团队在期刊《Journal of Experimental & Clinical Cancer Research》上在线发表题为“HSPA4 upregulation induces immune evasion via ALKBH5/CD58 axis in gastric cancer”的研究论文,研究结果有助于确定可能受益于免疫检查点阻断治疗的胃癌患者。

胃癌(GC)是全球癌症相关死亡的主要原因之一。最近,包括PD1(程序性细胞死亡1)抗体在内的靶向治疗已被用于晚期胃癌患者。然而,寻找新的免疫治疗生物标志物仍然是迫切需要的。本研究旨在揭示胃癌细胞的免疫逃逸机制,并为胃癌患者的免疫检查点阻断治疗寻找新的生物标志物。
热休克蛋白(HSPs)是一个高度保守的分子伴侣蛋白家族,在具有挑战性的环境或病理应激下被诱导。热休克蛋白参与蛋白质的组装、分泌、转运、蛋白质降解和转录因子调控,从而维持蛋白质稳态。它们还参与癌细胞的许多生物学过程,如调节细胞增殖、血管生成和逃避凋亡。热休克蛋白的异常表达在多种癌症中都有报道,包括肺癌、乳腺癌、前列腺癌和卵巢癌,并与不良预后相关。
HSPA4(热休克蛋白家族A (Hsp70)成员4)是Hsp110家族的代表,在各种癌症类型中表达上调。HSPA4上调与HNSC和肝细胞癌(HCC)的总生存期(OS)较差相关。敲低HSPA4可延缓结直肠癌细胞的进展和发展。越来越多证据表明,HSPA4可能不仅参与某些癌症的进展,还可能参与免疫调节。生物信息学分析提示HSPA4上调与HCC中免疫细胞浸润和免疫检查点(PD1和CTLA-4)呈正相关。此外,B细胞选择性产生靶向糖基化膜蛋白HSPA4的致病性IgG抗体,促进乳腺癌淋巴结转移。
在本研究中,研究人员发现HSPA4在胃癌组织中表达上调,并介导肿瘤细胞的免疫逃逸。研究人员进一步揭示了HSPA4/ALKBH5/CD58轴上调胃癌细胞中PDL1表达并抑制肿瘤环境中CD8+T细胞毒性的分子机制。此外,研究人员报道,尽管HSPA4上调与胃癌患者的不良预后相关,但HSPA4上调可能是预测胃癌患者对PD1检查点阻断治疗更好反应的有价值的生物标志物。
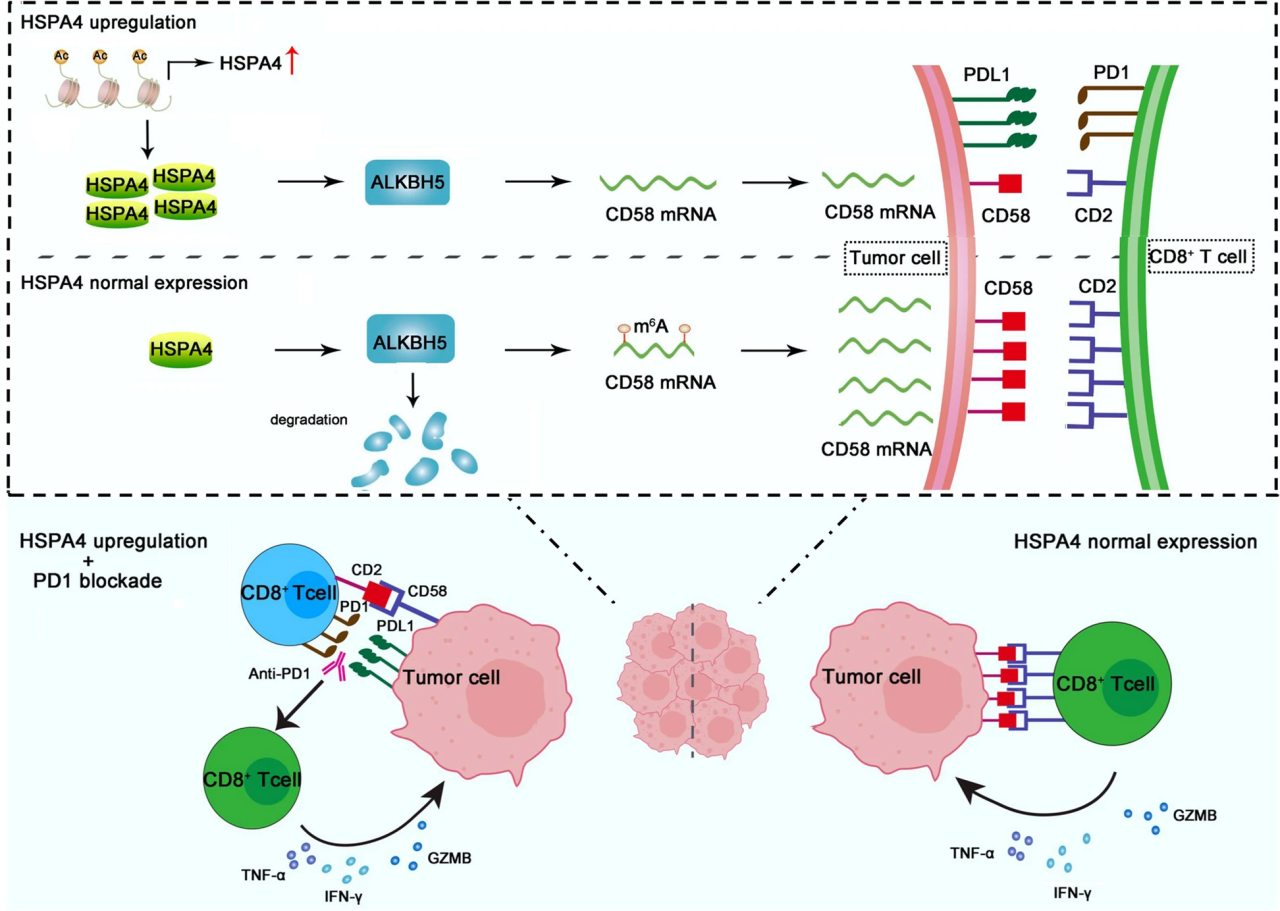
综上所述,研究结果有助于确定可能受益于免疫检查点阻断治疗的胃癌患者。
参考资料:
https://jeccr.biomedcentral.com/articles/10.1186/s13046-024-03029-4
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942

