以肠道微生物为目标的饮食可调节人体免疫状态
摘要
饮食可以调节肠道微生物群,从而影响免疫系统。在这里,作者确定了植物纤维和发酵食品是如何影响健康成年人的人体微生物组和免疫系统。通过一项17周的随机、前瞻性研究(n=18/组),结合微生物组学和宿主分析,包括广泛的免疫图谱,作者发现了饮食特异性的影响。高纤维饮食增加了编码碳水化合物活性酶(CAZymes)微生物,它们能降解聚糖。虽然细胞因子反应评分(主要结果)没有变化,但高纤维饮食者的三种不同的免疫轨迹与微生物多样性基本一致。另外,高发酵食物的饮食稳定地增加了微生物群的多样性,减少了炎症标记物。这些数据强调了饮食干预与免疫的联合方式,以及微生物组分析可以提供个人或全体的见解。发酵食品可能有助于对抗工业化社会普遍存在的微生物组多样性下降和炎症增加。

结果
1、在研究过程中,参与者成功地增加了指定的膳食纤维或发酵食品的摄入量
1.1根据参与者每2周生成的食物日志中的宏量营养素和微量营养素数据,参与者成功地增加了纤维或发酵食品的摄入量(图S2)。在研究过程中,高纤维饮食组的参与者并没有增加发酵食品的摄入量(图1C,虚线),食用高发酵食品组的参与者也没有增加纤维摄入量(图1D,虚线)。
1.2尽管所有参与者都遵循了饮食干预的要求,但每个参与者在他们食用的富含纤维或发酵食品的特定子类别方面实施了不同的干预(图 S2A 和 S2B)。
1.3从基线到干预结束,发酵食品组炎症标志物的减少和微生物群多样性的增加是显著的;高纤维组SCFAs的一个特定子集显著减少。
1.4根据alpha和beta多样性测量结果,两组参与者在基线时的肠道菌群没有差异(图S1A和S1B)。
2、高纤维饮食和高发酵食品饮食会对肠道微生物群和宿主免疫系统产生明显的影响
2.1 myosin-1,它在高发酵食品饲粮组中增加了(图2B)。
2.2总体微生物群组成模型的特征是,相对于基线,高纤维饮食组的Lachnospira属的数量增加,而高发酵食物组的Lachnospira属的数量减少(图2C)。
2.3个体的微生物群组成在干预过程中变得与其他参与者更相似。
2.4两种饮食干预在参与者的人体和微生物的生物学中产生了特征反应,相比于免疫系统的变化,饮食引起的微生物群变化会更一致。
3、纤维的摄入改变了微生物群的碳水化合物处理能力和代谢输出
3.1 alpha多样性在干预过程中并没有发生队列范围内的变化(图3A、S1C和S1D)
3.2高纤维饮食组每克粪便中微生物蛋白的相对丰度有所增加, Lachnospira相对丰度有所增加.
3.3高纤维饮食导致了整个队列复杂碳水化合物处理能力的增加,而不仅仅是碳水化合物化功能的配置
3.4没有观察到丁酸盐的增加, 可能是由于不完全发酵和/或宿主结肠吸收; 观察到支链脂肪酸(BCFAs)异丁酸和异戊酸以及缬氨酸从基线到维持期结束的下降(图3D)。
3.5参与者纤维摄入量的增加与粪便碳水化合物总量的增加显著相关,但是参与者的微生物群对碳水化合物的降解不足以处理增加的纤维消耗
4、高纤维组的免疫系统分析揭示了宿主对纤维摄入反应的亚型
4.1高炎症参与者的稳态免疫激活明显增加,而低炎症参与者的稳态免疫激活明显减少。
4.2发现低炎症ii组的微生物群多样性高于高炎症组,低炎症组的微生物多样性有增加的趋势。
4.3 Akkermansia在高炎症组中相对于低炎症组富集。
5、发酵食物的摄入增加了微生物群的多样性
5.1与高纤维饮食组相比,食用高发酵食物组的参与者在干预过程中表现出α多样性的总体增加,这是由整体ASVs、系统发育多样性(PD)全树和Shannon多样性决定的(图5A、5B和S1E)。
5.2在高发酵食物组没有观察到每克粪便微生物蛋白的相对丰度增加,这表明改变的微生物密度并没有伴随多样性的增加。
5.3在高发酵食物饮食环节,微生物多样性的增加主要不是由于消耗的微生物,而是由于转移或新获取到微生物群落的结果。
6、发酵食物的摄入减少了宿主炎症的标志物
6.1确定了19种蛋白在发酵食品干预后下降,包括IL-6、IL-10和IL-12b等炎症因子(图6A)
6.2在所有四种细胞类型(CD4+ T细胞;CD8+ T细胞;B细胞;和传统的单核细胞)的测试中都观察到信号通路的减少。
6.3发现效应记忆CD4+T细胞在干预期间增加,非经典单核细胞减少(图6C和S3)。
7、系统级微生物组和免疫系统纵向分析作为揭示宿主-微生物协调关系的一种方法
7.1微生物群和宿主特征类型之间存在大量显著相关性
7.2 CAZymes和疾病相关蛋白之间的大部分相关性为负,与炎症反应相关的蛋白具有最高的显著相关性(图7B)
7.3随着粪便丁酸的增加,B细胞频率降低(图7C)
7.4随着参与者的微生物组CAZymes相对丰度的增加,它们可能会表现出基础炎症状态的降低,并在细胞因子刺激后反应较弱。
图解
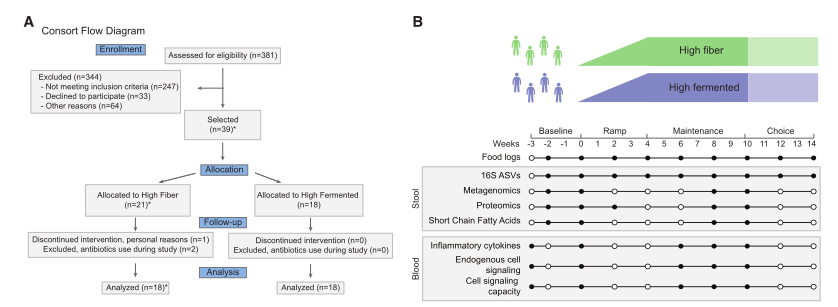
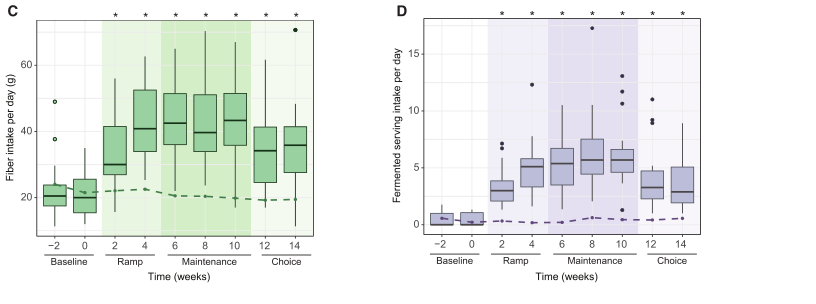
图1 纤维发酵食品研究综述
(A) 配合参与者注册、分配、跟踪和分析的流程图。侧边图显示了每个平台收集的高纤维(Fi)和高发酵(Fe)饮食组的参与者人数。2名参与者根据特殊要求被分配到高纤维组,而不是随机分配的。
(B) 为期14周的研究概述时间表、样本类型收集及相应的实验平台。
(C) 箱形图显示高纤维饮食组的纤维摄入量;虚线所示的高发酵食物组的纤维摄入量。
(D) 箱形图中显示的是高发酵食物饮食中的发酵食物摄入量;虚线显示的是高纤维食物中的发酵食物摄入量。P ≤0.05,通过t检验,用星号表示,计算每个时间点相对于基线(每2周)。
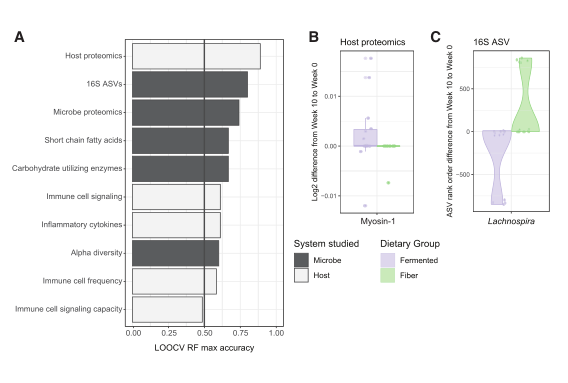
图2 纤维与发酵食品干预对宿主和微生物组的饮食特异性影响
(A) 随机森林模型预测饮食组的留一法交叉验证(LOOCV)的准确性; 使用宿主衍生数据(白条)或微生物衍生数据(黑条)分离模型,使用从基线到维护结束的参数变化作为模型特征。递归特征消除选择了最大精度所需的最少参数数量。 黑线代表 50% 的准确率(概率预测)。
(B) myosin-1差异,模型特征选择为宿主蛋白组学模型。
(C) Lachnospira 排序变化的差异,为 16S 扩增子序列变体 (ASV) 模型选择的模型特征。 紫色,发酵组; 绿色,纤维组。
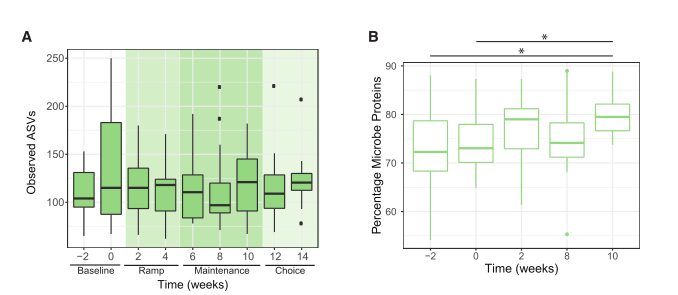
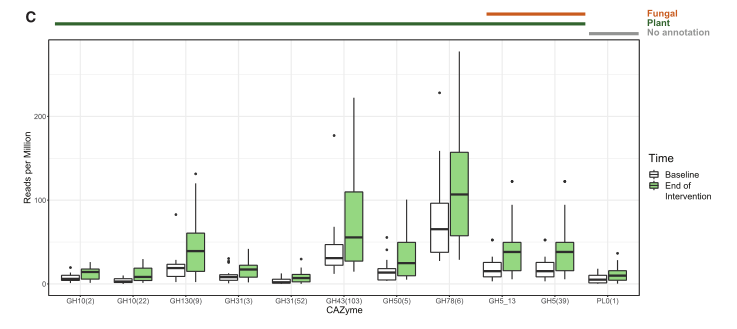
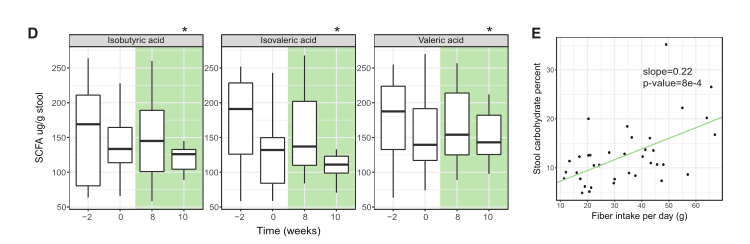
图3 食用纤维的参与者表现出微生物组功能特征的变化
(A) 从 16S rRNA 扩增子测序中观察到的 ASV 数量; 与基线相比,任何干预时间点都没有显着变化(第 2 周或第 0 周;配对 t 检验)。
(B) 使用LC-MS (Gonzalez等人,2020年)测量的蛋白质通过HMP1数据库分类为人类或微生物衍生的蛋白质(人类微生物组项目联盟,2012年)。从基线到维持期结束,微生物蛋白占总粪便蛋白的百分比增加(第10周,从第2周p = 0.003,从第0周p = 0.01,配对t检验)。
(C) CAZymes 从宏基因组测序中鉴定为从基线到维持阶段结束的相对丰度发生显着变化(FDR ≤ 0.05;q 值≤0.1;SAM 二级配对)。CAZymes 使用 dbCAN 进行注释并分配到功能类别(Yin 等人,2012 年;Huang 等人,2018 年)。
(D) 粪便中两支链脂肪酸和戊酸显著降低(p = 0.044, 0.033, 0.033;配对t检验)。异常值没有绘制出来,但所有值都包含在统计分析测试中(见STAR方法)。
(E) 通过线性混合效应(LME)模型,总纤维摄入量(克)与粪便中碳水化合物的百分比相关(p = 8e-4)。
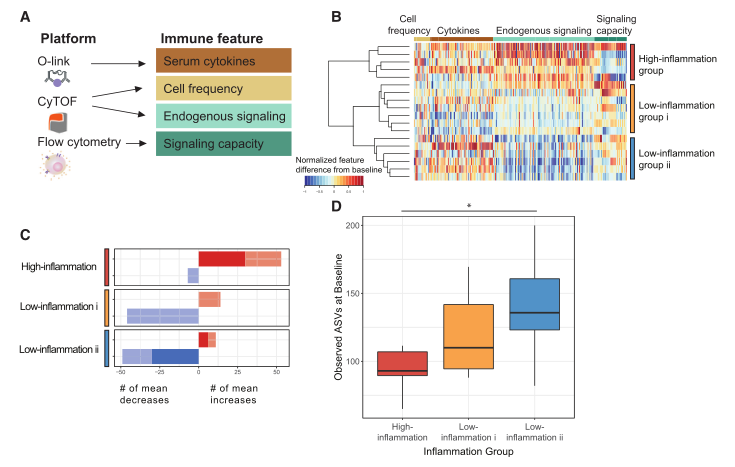
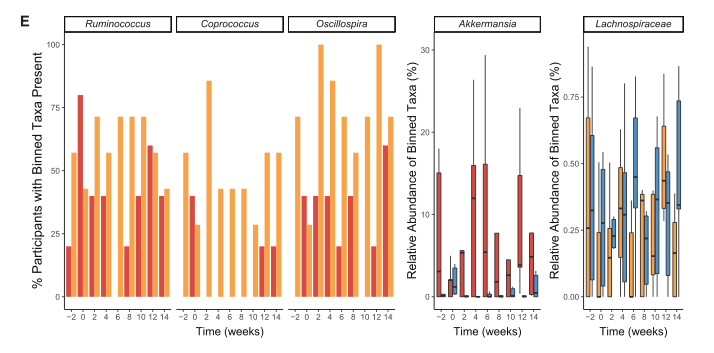
图4纤维组表现出不同的免疫反应,这些反应会随着微生物多样性的差异而变化
(A) 免疫表型分析的免疫特征。
(B) 热图描绘了从基线(第 3 周)到干预结束(第 10 周)的免疫特征(按免疫特征类型分组)的差异,从最小变化(>-1)重新调整到最大变化(<1); 没有变化,0。每一行都是一个参与者,并且通过光纤臂上的特征值分层聚类对行进行聚类。
(C) 三个组患者的平均阳性(红色)或平均阴性(蓝色)的计数改变了从基线(第 3 周)到维持结束(第 10 周)的内源性免疫细胞信号传导。非显著性变化以浅色显示;深色显示出显著变化(SAM;两级配对; q-value ≤0.1)。
(D) 基线时观察到的asv平均数量(第2周和第0周)高炎性簇(红色),低炎性簇(金色),低炎性簇(蓝色;未配对t检验显著性p = 0.037)。
(E) 使用tip_glom (R中的系统序列包)进行分类的显著类群在使用零膨胀beta回归的两两比较中被识别,并随时间绘制。
(F) 前三个面板中显示了高炎症(红色)和低炎症 i(金)集群中存在分类群的参与者的百分比(组对数模型调整 p ≤ 0.05); 高炎症(红色)和低炎症 ii(蓝色)簇的丰度(组成百分比)显示在第四组中(组 beta 回归模型调整 p ≤ 0.05); 低炎症 i(金色)和 ii(蓝色)簇的丰度和丰度(组成百分比)显示在第五组中(组 beta 回归模型调整 p≤ 0.05)。
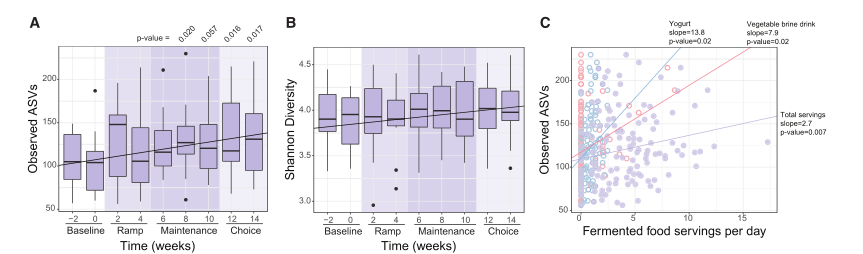
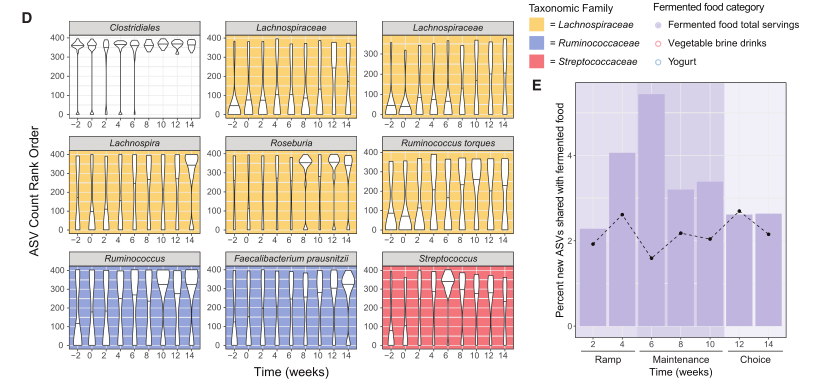
图5. 高发酵食物增加了微生物的多样性和改变了组成
(A,B)观察ASVs(一个;通过配对t检验生成的p值)和Shannon多样性(B)从基线增加到选择阶段。使用LME模型观察到的ASV与时间显着相关(对于观察到的ASV,p = 2.3e-3;对于 Shannon,p = 1.4e-3)。
(C)总发酵食物摄入量、酸奶和蔬菜盐水饮料与使用LME模型观察到的ASV呈正相关(校正后p ≤0.05)。
(D)随着时间的推移,使用LME模型(调整后的p≤ 0.05)与发酵食品消费显着相关的等级归一化ASV。图表按分类科着色。
(E)新的ASV (在基线周没有出现,第2或第0周,但在干预期间的任何其他时间检测到)对每个参与者的发酵食品中检测到的ASV进行汇总和求和,并绘制出高发酵食品饮食组按时间点的所有新asv的百分比。虚线表示高纤维饮食的趋势。
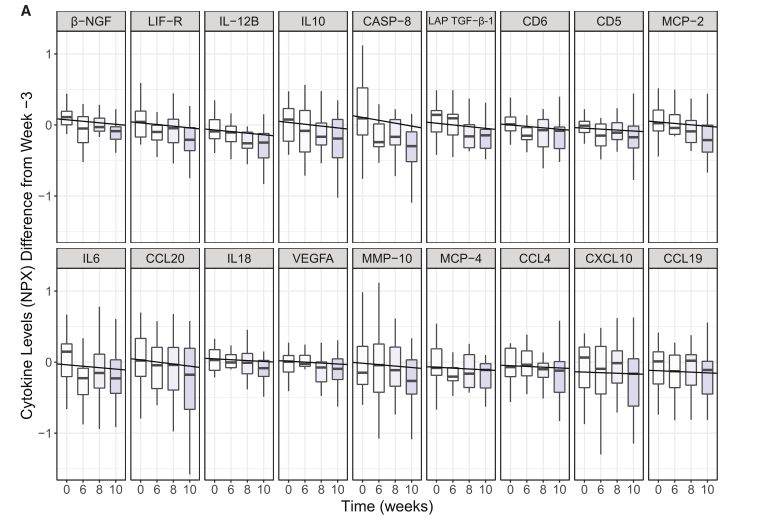
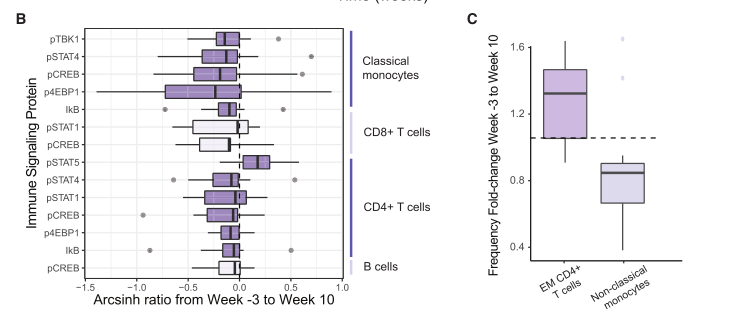
图6 食用发酵食品可以降低炎症水平
(A) 细胞因子、趋化因子和其他血清蛋白绘制了从基线(第 3 周)到干预结束(第 10 周;SAM 二级配对;FDR ≤ 0.05;q 值 ≤ 0.1)的显着变化。 使用LME计算的每个分析物水平随时间的负相关。 NPX 是指Olink Proteomics的log2量表使用的标准化蛋白质表达。Fgf-21也随时间显着下降(数据未显示)。
(B) 使用 CyTOF 测量的细胞类型特异性内源性信号蛋白,从基线(第 3 周)到干预结束(第 10 周;SAM 两级配对;FDR < 10%)发生显着变化。 Arcsinh 比率从第 3 周到第 10 周绘制。
(C) 从基线(第 3 周)到干预结束(第 10 周;Wilcoxon 配对检验;调整后的 p≤ 0.05)显着变化的细胞频率的倍数变化(计算为 CD45+ 细胞的百分比)。
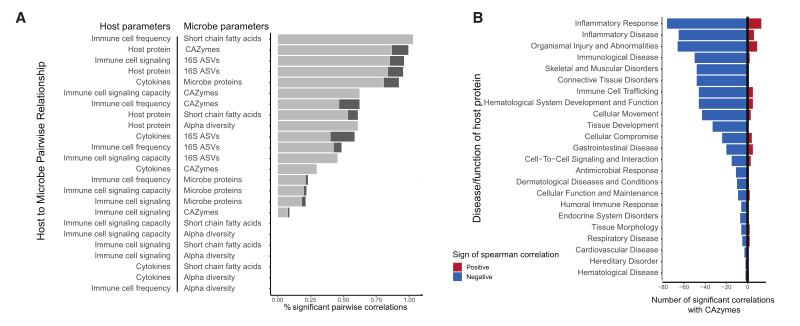

图7 宿主免疫系统和微生物群之间的相互作用
(A) 计算每个参数的基线和维护结束之间差异的相关性,并绘制微生物和宿主测定之间显着成对相关性的百分比。 浅灰色表示与调整后的 p≤0.05 的相关性; 深灰色显示调整后的 p ≤0.01(BenjaminiHochberg 假设校正)。
(B) 疾病或功能注释的宿主蛋白与CAZymes之间正相关(红色)和负相关(蓝色)(p值调整≤ 0.05)。
(C) 高纤维(绿色)和高发酵食品(紫色)组从基线(第3周大便;第2周血液)到维持结束(第 10 周)的粪便丁酸盐水平与血B细胞频率的变化。((斜率= -0.49,调整后的p值= 0.033;B细胞被定义为CD45+、CD66-、CD3-、CD19-;频率量化为 B 细胞频率,作为 CD45+ 和 CD66- 细胞的一部分。
CAZymes(由 CAZy 家族着色)与免疫细胞信号传导能力之间的显着相关性,由 pSTAT、细胞类型和刺激性细胞因子标记(p 值调整为 0.05%)。
期刊:Cell
IF:41.58
时间:2021.6
通讯作者:Erica D. Sonnenburg
通讯作者单位:斯坦福大学医学院微生物学与免疫学
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942

