改变肠道黏蛋白的修饰类型竟然影响宿主疾病代谢表型
——摘要——
肠道粘蛋白在防御细菌入侵和维持肠道菌群方面起着至关重要的作用,并有助于调节宿主免疫系,因此,其失调是代谢疾病和肠道炎症的标志。然而,肠道粘蛋白控制肠道微生物群以及疾病表型的机制仍然不清楚。在本文中,我们报道了肠粘蛋白O-聚糖的N-乙酰葡糖胺(GlcNAc)-6-O-硫酸化对肥胖和肠道炎症具有预防作用。Chst4-/-小鼠,一种缺乏GlcNAc-6-O-硫酸化作用的粘蛋白O-聚糖的小鼠,表显出显着的体重增加和对葡聚糖硫酸钠诱导的结肠炎以及结肠炎相关癌症的敏感性增加,伴有由滤泡辅助性T细胞介导的IgA反应受损引起的免疫球蛋白A(IgA)产生显着减少。有趣的是,GlcNAc-6-O-硫酸化对肥胖和肠道炎症的保护作用取决于肠道微生物群,通过同笼饲养或微生物群移植来调节肠道微生物群来逆转疾病表型和IgA产生。总的来说,我们的研究结果为宿主糖基化(更具体地说是肠道粘蛋白上的GlcNAc-6-O-硫酸化)通过调节肠道微生物群来预防肥胖和肠道炎症的重要性提供了新的见解。
——文献阅读——
首先补充一下背景知识,因为粘液屏障是保护胃肠道的第一道保护线之一,粘液屏障的调节越来越受到科学界的关注。在影响粘液屏障的因素中,微生物组在驱动粘液变化方面起着重要作用,通过研究其化学组成,来探讨微生物群合成和降解对其的调节以及其对宿主代谢表型的一个影响。肠道黏液是一大类复杂的糖基化蛋白,超过80%的黏蛋白是由O-聚糖组成,O聚糖是影响黏蛋白的主要修饰和糖基化类型。chst4是编码N-乙酰葡糖胺6-O磺基转移酶的基因,该酶可催化硫酸基从3’磷酸腺苷5’磷酸硫酸盐转移到O-连接黏蛋白型聚糖中非还原N-乙酰葡糖胺残基的6-羟基上。后续该文章的实验基础就是使用缺乏该基因的基因敲除小鼠。由于肠道粘蛋白可以抵御细菌入侵和维持肠道菌群稳态,肠道微生物可调节宿主免疫,而肠道黏蛋白又是代谢性疾病和肠道炎症的标志,借此提出问题,肠道黏蛋白又是如何影响肠道菌群以及宿主疾病表型呢?因此该文章以上述敲基因小鼠为研究对象对该问题进行深入探讨。
在用普通饲料喂养小鼠的时候,敲基因小鼠出现明显的体重增加和脂肪堆积现象,并伴随着血糖糖耐量受损和胰岛素抵抗现象。同样在高脂饮食喂养的小鼠上也更早出现该种情况,表明肠道黏蛋白GlcNAc-6-O-硫酸化缺乏的会促进年龄和饮食相关的肥胖。
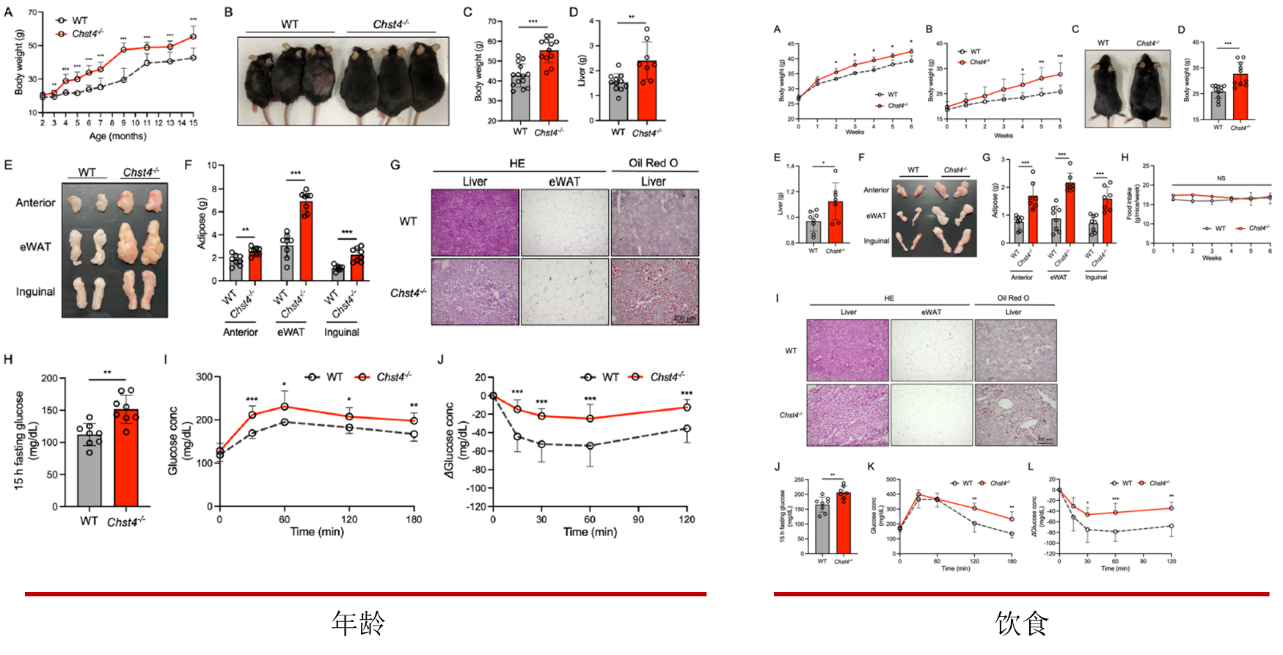
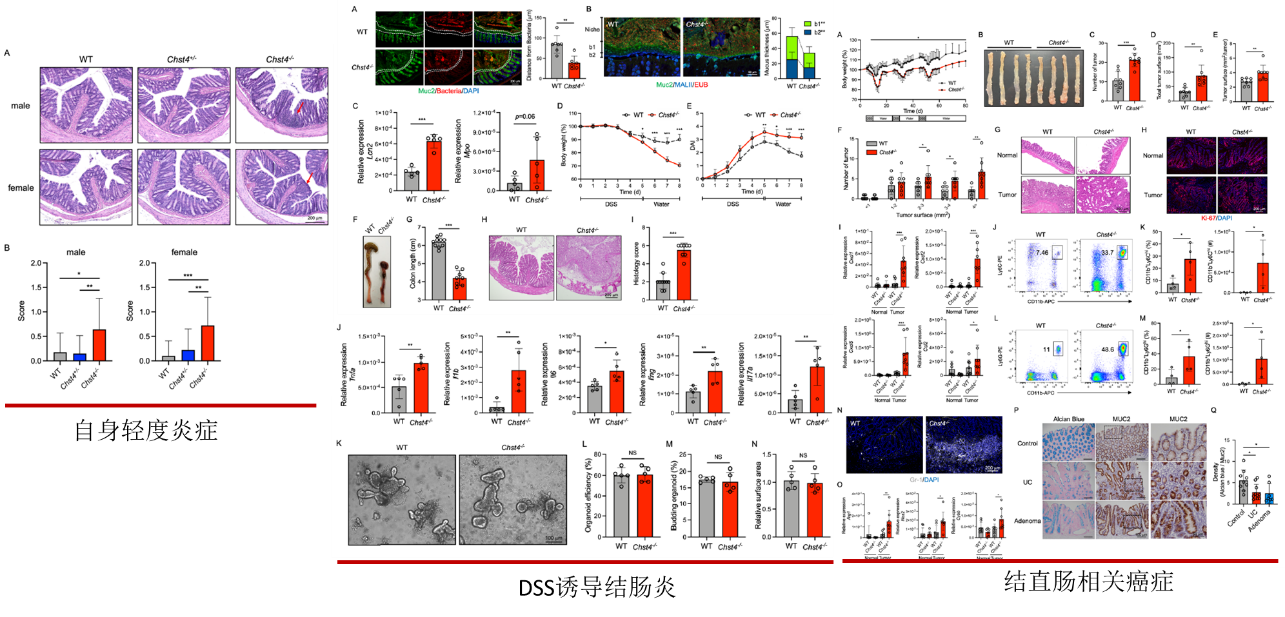
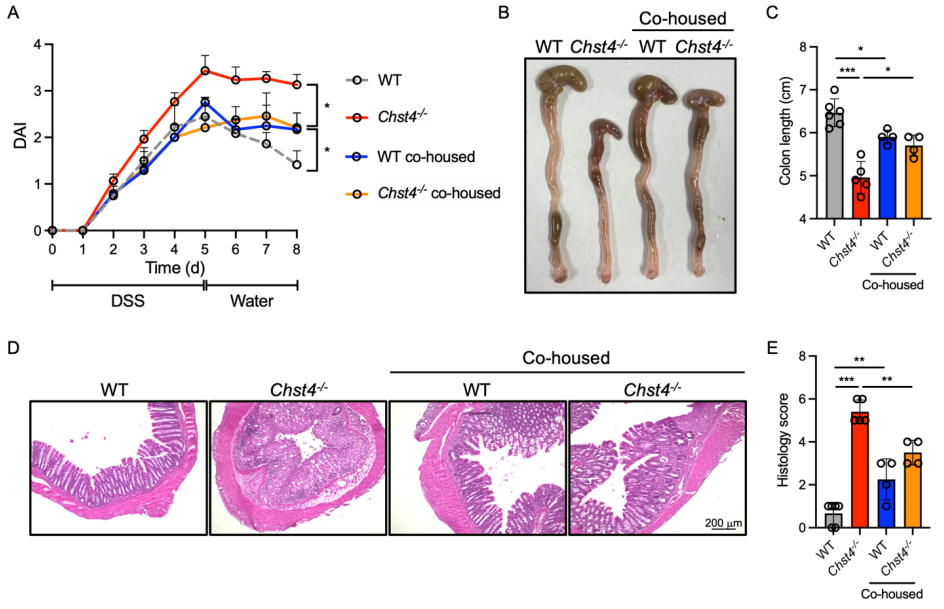
肥胖与肠道炎症密切相关,因此探讨了该基因的缺失会在多大程度上影响炎症。首先观察到细菌和宿主上皮细胞更接近,表明细菌向黏液层的迁移比WT小鼠增加。而近期研究结果中表示结肠粘液由Muc2的两个不同的o -糖基化层组成,主要形式(b1层)由近端结肠产生,次要形式(b2层)来自远端结肠。为了确定Chst4-/-小鼠中哪一层黏液主要丢失,我们用MALII对结肠组织进行了染色我们发现,与WT小鼠相比,Chst4-/-小鼠的b1和b2层均显著减少。我们在基因敲除小鼠的大肠组织中检测到脂钙素2的表达显著增加,表明出现肠道炎症。其次通过HE染色观察发现该基因敲除小鼠结肠出现明显的炎症浸润,表明其本身会自发的出现轻度炎症。为了继续探讨会在多大程度上影响炎症,对小鼠进行DSS诱导的结肠炎。基因敲除小鼠表现出更大的体重减轻,并且未能从上皮损伤中恢复,如更高的疾病活动指数评分,结肠长度缩短和和更高表达量的促炎因子。表明粘蛋白o -聚糖的glcnac -6-O-硫酸化对于防止dss诱导的结肠损伤是必不可少的。同样情况也出现在结直肠癌上,发现基因敲除小鼠出现更多的肿瘤以及髓源性抑制细胞浸润增加,以及相关肿瘤免疫因子表达量增加。同样在临床样本中也验证我们的发现,与健康对照相比,我们在UC和结肠癌患者的样本中检测到较少的磺化。这些发现表明,表明粘蛋白o -聚糖磺化不足可能与UC和结肠癌的恶化有关,粘蛋白O型糖 GlcNAc-6-O-硫酸化的缺失,促进结肠炎及相关癌症的易感性。
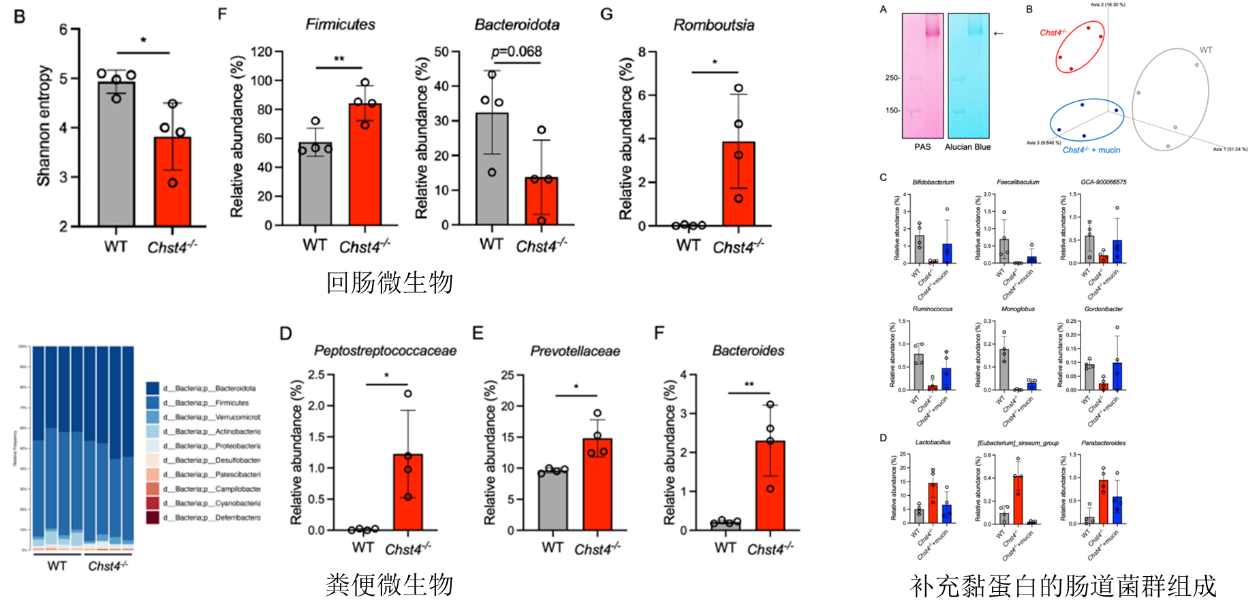
上述探讨该基因的缺失对疾病表型的影响,那对肠道菌群又是出现的怎样的变化呢?扩增子测序结果显示基因敲除小鼠的回肠和粪便菌群中多样性降低,肠道菌群稳态失衡,并且与疾病表型相关的菌群有所增加,但通过回补黏蛋白,可明显改善肠道菌群,表明黏蛋白GlcNAc -6- O -硫酸化具有维持肠道微生物群稳态。
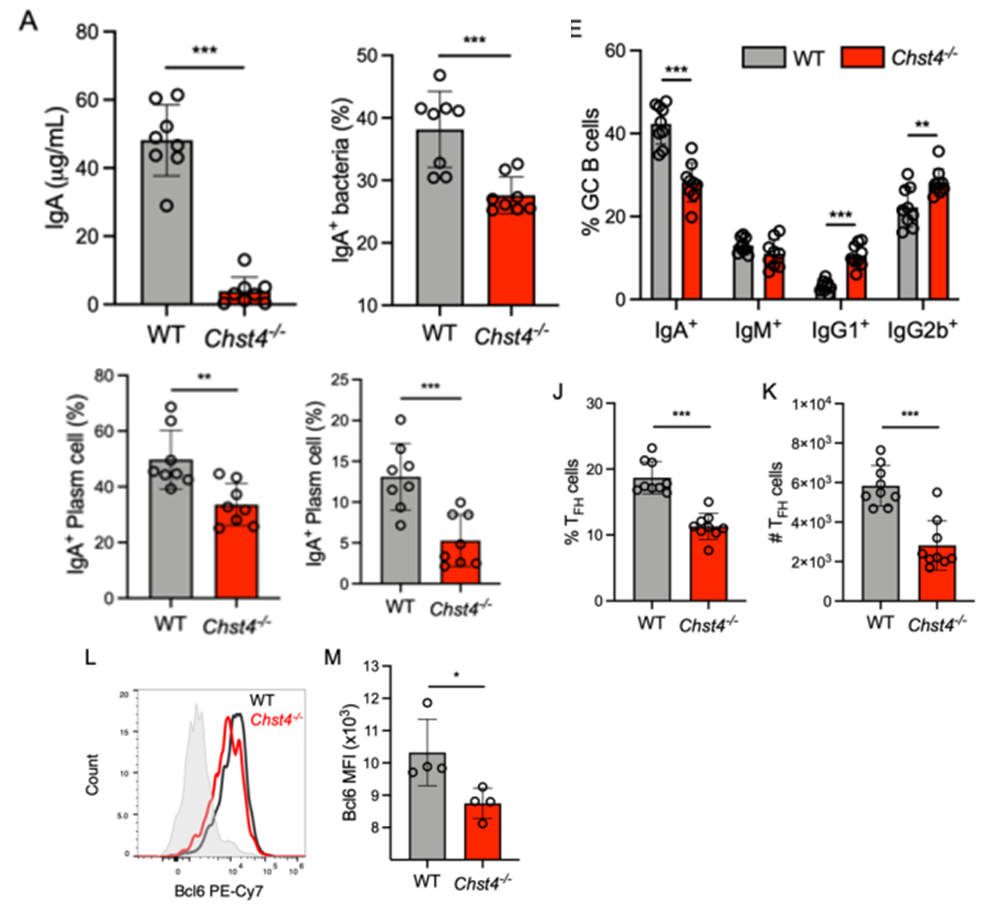
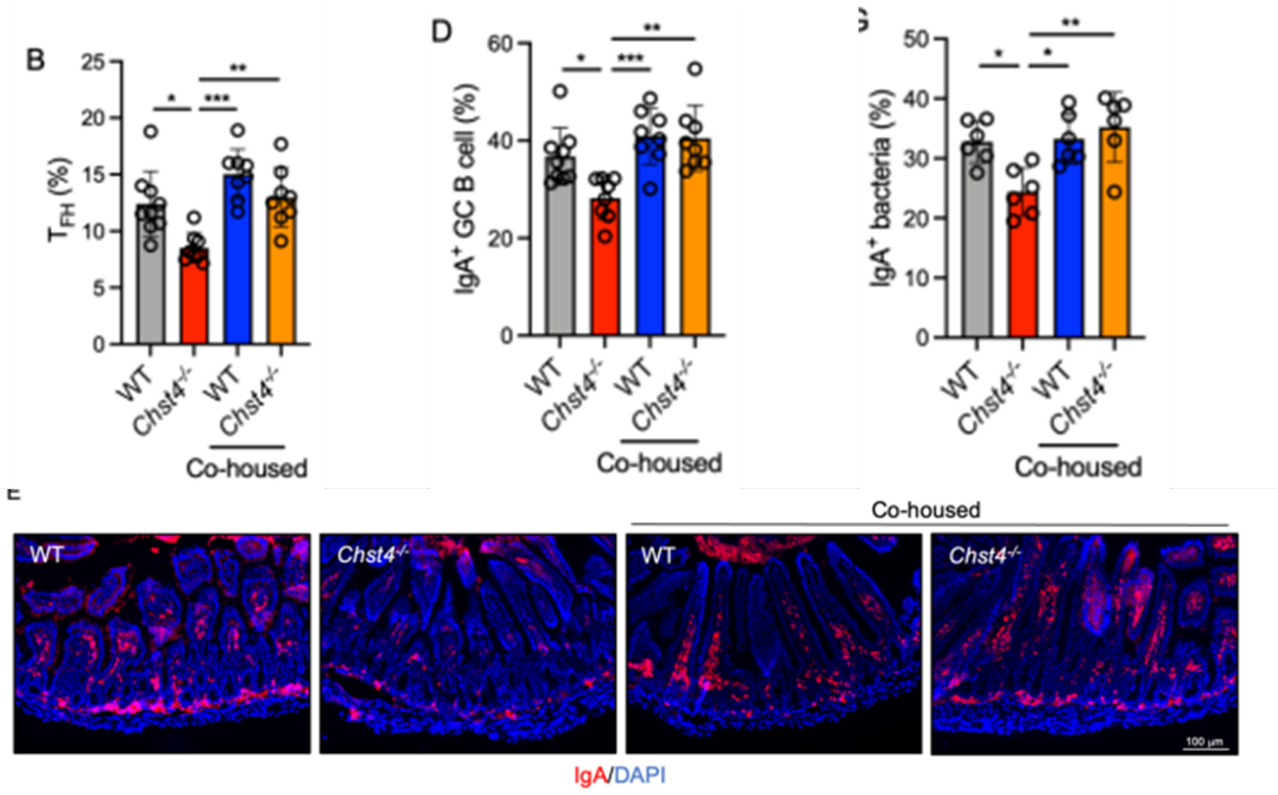
众所周知,肠道IgA可以调节肠道微生物组成,而IgA缺乏的小鼠存在微生物生态失调,导致其对结肠炎的易感性增加。那么基因敲除小鼠中IgA又是如何变化呢?检测发现基因敲除小鼠粪便中IGA降低,那又是如何影响的呢?首先向大家介绍一下相关背景知识,淋巴结是B细胞成熟的主要场所,滤泡协助性T细胞TFH可以与具有高抗原亲和力的B细胞结合,分泌细胞因子刺激B细胞,后者迁移回到B细胞区并大量增殖,形成生发中心(GC)。B细胞会在生发中心分化成熟形成浆细胞,分泌抗体,而且受到抗原刺激前后表达的抗体会完全不同。派尔集合淋巴结是肠黏膜免疫系统的重要组成部分,是小肠粘膜内的一组由B细胞和T细胞组成的淋巴滤泡,产生分泌IgA的浆细胞来参与肠道局部免疫。因此一步一步往上推发现表达IgA的生发中心B细胞也减少,而表达其他类型的免疫球蛋白的B细胞增加,表明该基因的缺失会影响其抗体类别转变。而B细胞的分化是由滤泡辅助性T细胞进行刺激,TFH细胞促进了PPs内GCs中的IgA类转换,该基因的缺失会导致T细胞相关转录因子Bcl6表达下降,TFH频率和绝对数量显著降低,TFH细胞分泌促进PPs中IgA的表达的细胞因子表达量也显著降低,表明glcnac -6-硫酸化缺失与TFH细胞分化缺陷有关,进而导致肠道组织中IgA生成减少,从而影响了肠道菌群。
后面作者采用抗生素处理验证了肠道菌群与体重之间俺的关系,发现抗生素处理后的基因敲除小鼠体重和脂肪量明显降低. 暗示基因敲除小鼠的肥胖表型是它们无法调控微生物群引起的,而具有正常粘蛋白o-聚糖硫酸化的小鼠微生物群可以防止hfd诱导的肥胖。并随后展开了验证,对小鼠进行同笼饲养,发现同笼饲养的基因敲除小鼠表现出更低的体重增加和脂肪堆积,并且肠道菌群也具有明显的转变。

同等情况也出现在DSS诱导的结肠炎小鼠中,同笼饲养的基因敲除小鼠展现出更好的生理健康状态。
并且对于基因缺失引起的IgA减少改变了肠道菌群,通过同笼饲养反作用于肠道菌群,促进基因敲除小鼠中IgA的增加。
由此得出以下结论:肠道黏蛋白O型糖N-乙酰葡糖胺(GlcNAc)-6-O-硫酸化的缺失,会促进年龄和饮食相关性肥胖,增加结肠炎及相关癌症的易感性;肠道黏蛋白GlcNAc-6-O-硫酸化有利于维持肠道菌群的组成和多样性,保持肠道稳态;肠道黏蛋白GlcNAc-6-O-硫酸化的缺失会导致肠道滤泡辅助性T细胞分化减少,引起IgA的分泌减少;通过调节肠道菌群,可以改善肠道黏蛋白GlcNAc-6-O-硫酸化缺失引起的相关宿主疾病表型,并增加肠部IgA的产生。
DOI: 10.1172/jci.insight.165944.
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942

