揭示调控肿瘤耐药和转移的新机制
近日,暨南大学药学院叶文才/张冬梅团队连续在国际权威学术期刊 Nature Metabolism 和 Advanced Science 发表了两篇研究论文。这两项研究分别报道了代谢重编程介导肿瘤对血管靶向药物耐药的新机制,以及周细胞离子通道调控肿瘤血行转移的分子机制。
发表在 Nature Metabolism 期刊的论文题为:ENO2-derived phosphoenolpyruvate functions as an endogenous inhibitor of HDAC1 and confers resistance to antiangiogenic therapy

发表在 Advanced Science 期刊的论文题为:TCAF2 in pericytes promotes colorectal cancer liver metastasis via inhibiting cold-sensing TRPM8 channel

结直肠癌(CRC)肝转移是肿瘤致死的主要原因,血管靶向药物广泛应用于转移性CRC的临床治疗,但耐药频发,亟需探究其机制和解决方案。
研究团队从代谢重编程的角度研究了血管靶向药物耐药的调控新机制,发现糖酵解酶烯醇化酶ENO2是驱动CRC对血管靶向药物耐药的关键因素,ENO2代谢产物磷酸烯醇丙酮酸(PEP)能选择性与HDAC1结合并抑制其活性,从而提高β-catenin乙酰化并激活β-catenin通路,进而促进CRC细胞恶性行为和耐药。联合使用ENO2抑制剂能有效克服血管靶向药物耐药。
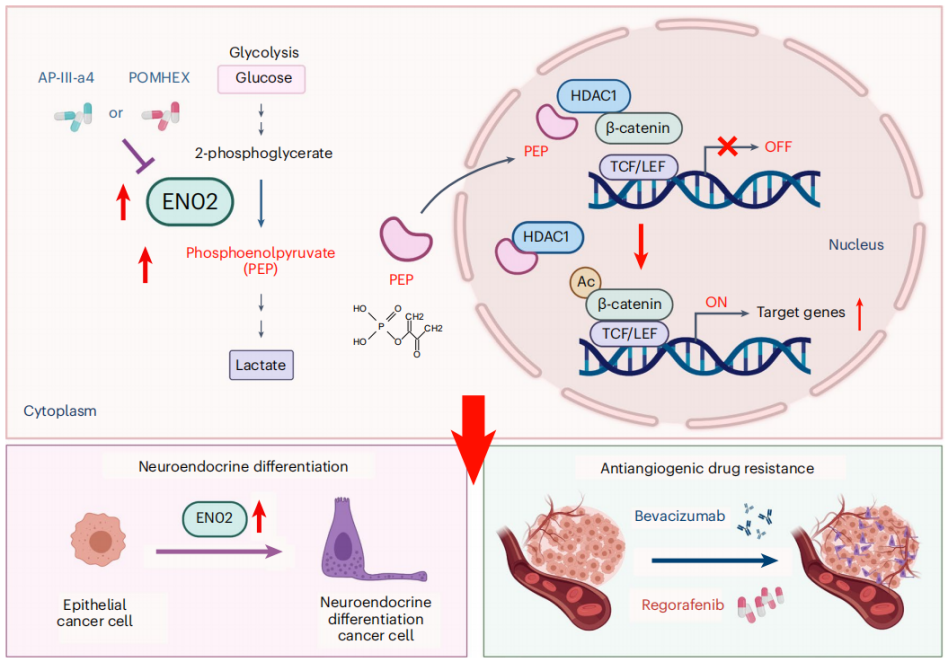
肿瘤细胞ENO2代谢重编程促进血管靶向药物耐药的作用机制图
该研究表明ENO2有望作为CRC对血管靶向药物耐药的预测性生物标志物和潜在治疗靶点,并首次揭示代谢产物PEP作为HDAC1抑制剂的新功能及其在血管靶向药物耐药中发挥的重要作用。
血行转移是CRC肝转移的最主要途径,而原发灶肿瘤细胞渗入肿瘤血管是血行转移的关键限速步骤。作为肿瘤血管的“守门员”,周细胞监管着肿瘤细胞渗入血管的过程,但调控机制仍不明确。
研究团队使用显微分离结合周细胞培养基条件培养的方法,从CRC患者手术切除的肿瘤组织中分离获得了周细胞,并通过蛋白质组学研究发现,CRC肝转移病人来源的肿瘤周细胞高表达TRP通道相关因子2(TCAF2)。TCAF2通过抑制TRPM8冷感受离子通道TRPM8的表达和活性,诱导肿瘤周细胞分泌Wnt5a,激活STAT3信号通路促进肿瘤细胞EMT和血行转移。TRPM8通道激动剂薄荷醇能有效抑制CRC的肝转移。

周细胞TCAF2促进结直肠癌肝转移的作用机制图
该研究首次揭示了血行转移过程中周细胞冷感受蛋白及其调控因子的新功能,为结直肠癌肝转移治疗提供潜在新靶点。
论文链接:https://www.nature.com/articles/s42255-023-00883-y
https://onlinelibrary.wiley.com/doi/10.1002/advs.202302717
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942

