聚多巴胺纳米颗粒被用于调节肠道免疫和肠道菌群治疗炎症性肠病
炎症性肠病是一种慢性难治型疾病,由多种复杂因素发展而来,包括遗传改变、免疫失调、环境和微生物失衡,在没有有效治疗的情况下,严重者可能导致结肠癌。许多研究表明,该病与肠粘膜免疫系统功能障碍和肠道微生物生态失调密切相关。目前该病的治疗策略包括由抗炎剂5-氨基水杨酸、糖皮质激素和免疫调节剂组成的非特异性治疗以及更加特异的生物治疗,如肿瘤坏死因子抗体。而临床以小分子药物、糖皮质激素、免疫抑制剂为主的药物由于清除率快、功能单一、缺乏靶向性等原因,治疗效果和副作用不足,大多无效。
近年来,纳米材料介导的抗炎和抗氧化损伤治疗已经出现,以对抗IBD。聚多巴胺纳米粒子(PDA NPs)凭借其良好的生物相容性、生物可降解性以及抗炎症和抗氧化能力而受到广泛关注。此外,PDA NPs由于其在无机和有机表面的湿粘附性,被广泛应用于表面改性、蛋白质固定化和细胞粘附等领域。具体来说,PDA NPs可通过刺激调节性T(Treg)细胞来调节肠道炎症。此外,由于含有大量的还原性基团,PDA NPs还具有有效的氧化还原能力以清除潜在的ROS。抗菌肽(Antimicrobial peptides, AMPs)主要由肠道内的Paneth细胞分泌,在维持肠道内稳态、防御肠道病原体和帮助形成共生菌群的组成方面发挥着重要作用。本研究受天然细胞膜包被的纳米颗粒具有避免清除和靶向炎症部位的能力的启发,通过将聚多巴胺纳米颗粒与抗菌肽mCRAMP偶联,并在外层包裹巨噬细胞膜,设计并制备了一种清除ROS和炎症导向的纳米药物,以期将PDA NPs的抗炎和免疫调节能力与AMP的菌群调节功能巧妙地结合起来,在调节肠道免疫应答的同时改善肠道菌群,以获得更好的治疗效果。研究者预计巨噬细胞膜不仅保护AMP的活性,而且由于其固有的炎症定向趋化能力而发挥靶向作用,这有助于纳米药物在炎症组织中的积累。
如图所示,首先采用溶液氧化法自聚合合成了聚多巴胺(PDA)纳米粒子。然后将制备好的PDA粒子用小鼠抗菌肽相关肽(mccramp,与LL-37的同系肽)进行Michael加成或席夫碱反应进行修饰,得到的抗菌肽修饰的纳米粒子(PDA@mCRAMP, PC NPs)。然后用巨噬细胞膜包被PC NPs,采用挤压法(图1A)制备仿生纳米药物(PDA@mCRAMP@MM, PCM NPs)。体外研究表明,由于PCM NPs在抗氧化应激方面的突出表现,PCM NPs作为免疫抑制调节剂对细胞抗炎症具有缓解作用。此外,PCM NPs治疗组在葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的结肠炎模型中,有效地防止了肠屏障的破坏,保护了肠黏膜的完整性,表现为促炎性物质的分泌减少细胞因子和抗炎因子的过度表达。此外,粪便微生物16S rRNA测序显示口服纳米药物后,益生菌增加,致病菌受到抑制,PCM NPs正向调节小鼠肠道微生物,表明所设计的纳米平台在优化肠道微生物组方面发挥了重要作用(图1B)。综上所述,研究者所设计的纳米药物不仅制备简单、生物相容性高,而且具有炎症靶向性、抗炎功能和对肠道菌群的正向调节作用,为结肠炎的干预和治疗提供了新的思路。
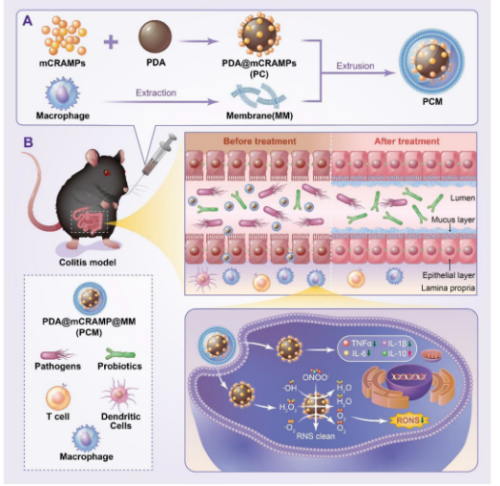
图1巨噬细胞膜包被抗菌肽修饰的聚多巴胺纳米颗粒靶向治疗结肠炎的机制图。A)制备的PDA纳米颗粒与抗菌肽mCRAMP偶联形成PC NPs,然后与提取的巨噬细胞膜挤压形成PCM NPs。B)口服PCM NPs治疗小鼠结肠炎。PCM NPs在炎症的结肠黏膜中积累,通过抑制促炎因子的分泌和提高抗炎细胞因子的表达来调节肠道炎症,同时通过增加益生菌的丰度和抑制有害菌群来减少RONS的产生,减轻氧化损伤,优化肠道菌群的组成。
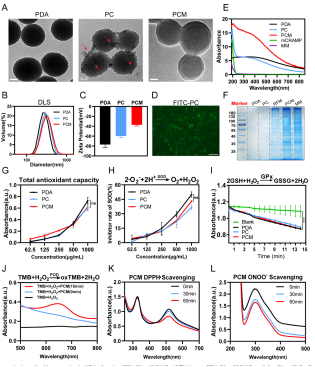
图2 PDA, PC和PCM NPs的表征和多酶模拟能力检测
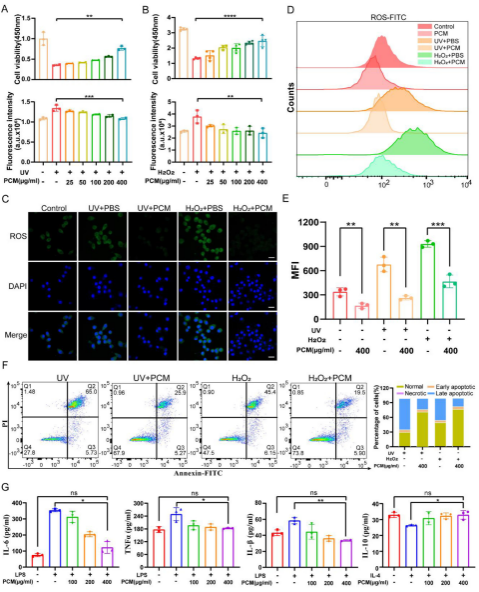
图3 PCM NPs对RAW264.7细胞氧化应激的抗氧化特性和炎症缓解作用
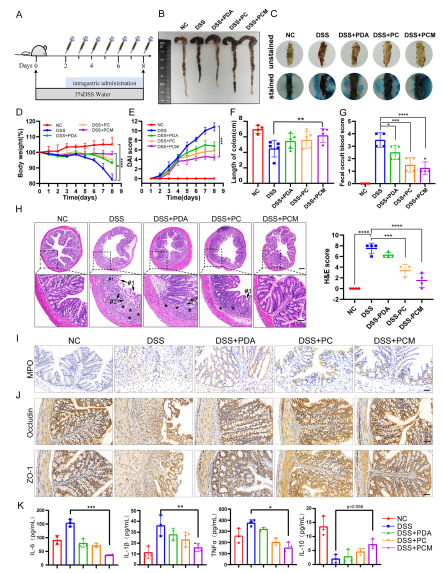
图4 PCM NPs对dss性结肠炎小鼠的治疗作用
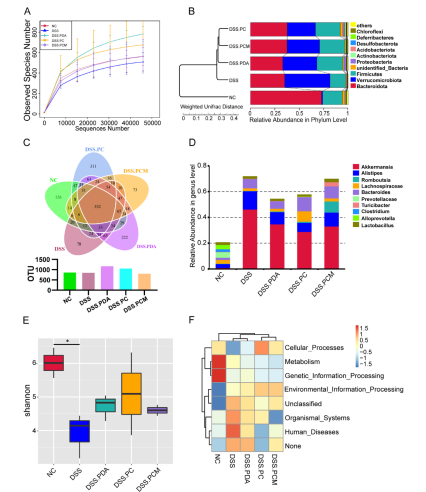
图5 NC、DSS、DSS肠道微生物结构的多样性和分布
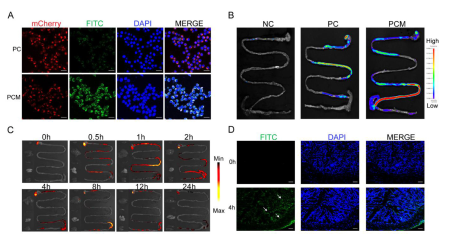
图6 荧光成像与体内外生物分布
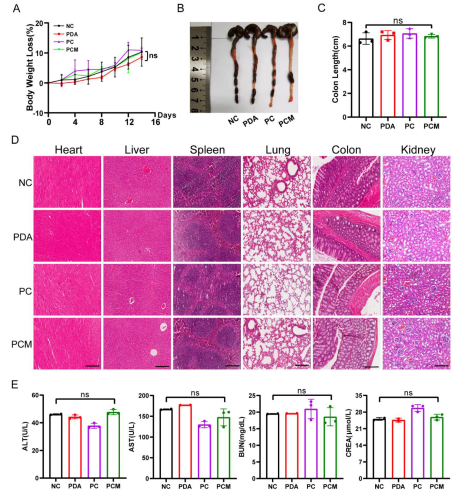
图7 初步生物安全评价
本研究利用了聚多巴胺NPs具有良好的生物相容性、低毒性、抗炎和抗氧化的特性。研究结果表明,AMP对肠道菌群具有广谱调控作用,而包裹在PC NPs外层的巨噬细胞膜不仅保护AMP的活性,而且对先天炎性趋化具有靶向作用。细胞和动物实验均表明,PCM NPs可降低促炎因子(IL-6、TNFα、IL-1β)的分泌,增加抗炎因子(IL-10)的分泌。在DSS诱导的结肠炎模型中,PCM NPs治疗组有效阻止了肠屏障的破坏,肠道恢复较好。微生物16S rRNA测序结果显示,肠道微生态受到调控,有益菌群增加,有害菌群减少。KEGG信号通路热图分析也显示,与DSS组相比,PCM NPs组的人类疾病信号通路明显减少。该设计发挥了抗炎和调节肠道微生态的综合治疗作用,为临床治疗结肠炎提供了新的策略。
论文链接:https://doi.org/10.1016/j.actbio.2023.02.026
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942

