温和噬菌-抗生素协同灭菌
迄今为止,所有噬菌体治疗都使用了烈性噬菌体,而非温和噬菌体,因为温和噬菌体可以整合到细菌宿主的基因组中并处于休眠状态。然而,温和噬菌体是相对丰富的,更容易分离。为了利用这些温和噬菌体,作者利用已知的压力原(抗生素)来唤醒这些休眠的整合噬菌体。将温和噬菌体HK97与亚抑菌浓度的环丙沙星共同使用,可在体外消除细菌(>8log降低)。
概略:

温和噬菌-抗生素协同灭菌是由溶原耗竭所驱动的:即温和噬菌体通过整合进宿主菌中,导致溶原性宿主的抗生素敏感性降低,低浓度的抗生素诱导溶原菌内噬菌体裂解,耗尽溶原菌株种群,即杀灭耐药细菌。
亮点:
1 温和噬菌体HK97与环丙沙星协同杀灭大肠杆菌
2 机制:温和噬菌体-抗生素协同作用是由溶原耗竭所驱动
3 机制上不同于传统的噬菌体-抗生素协同作用
结果:
1. 温和噬菌体和抗生素协同抑制细菌生长
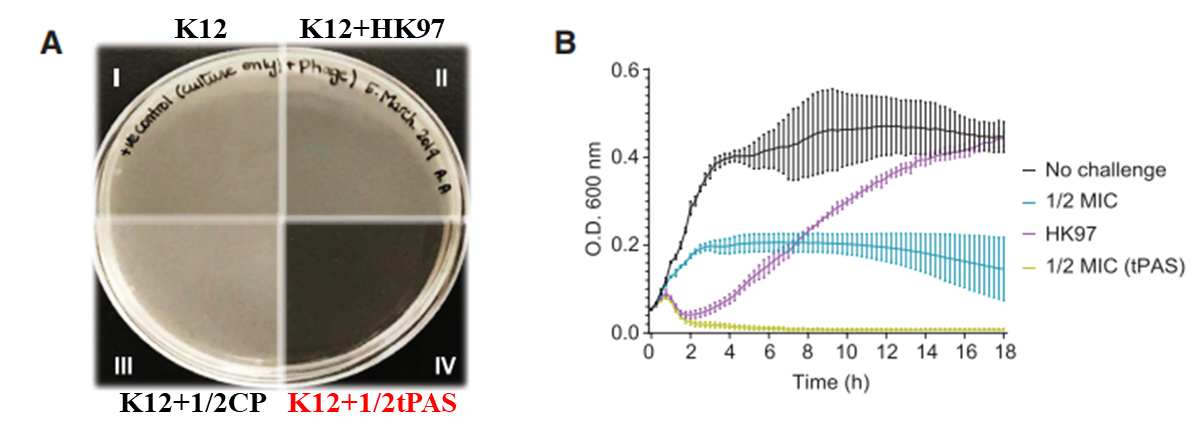
温和噬菌体HK97与1/2MIC的环丙沙星(CP)联合使用可协同抑制细菌K12的生长
2. 定量衡量tPAS的杀菌效果
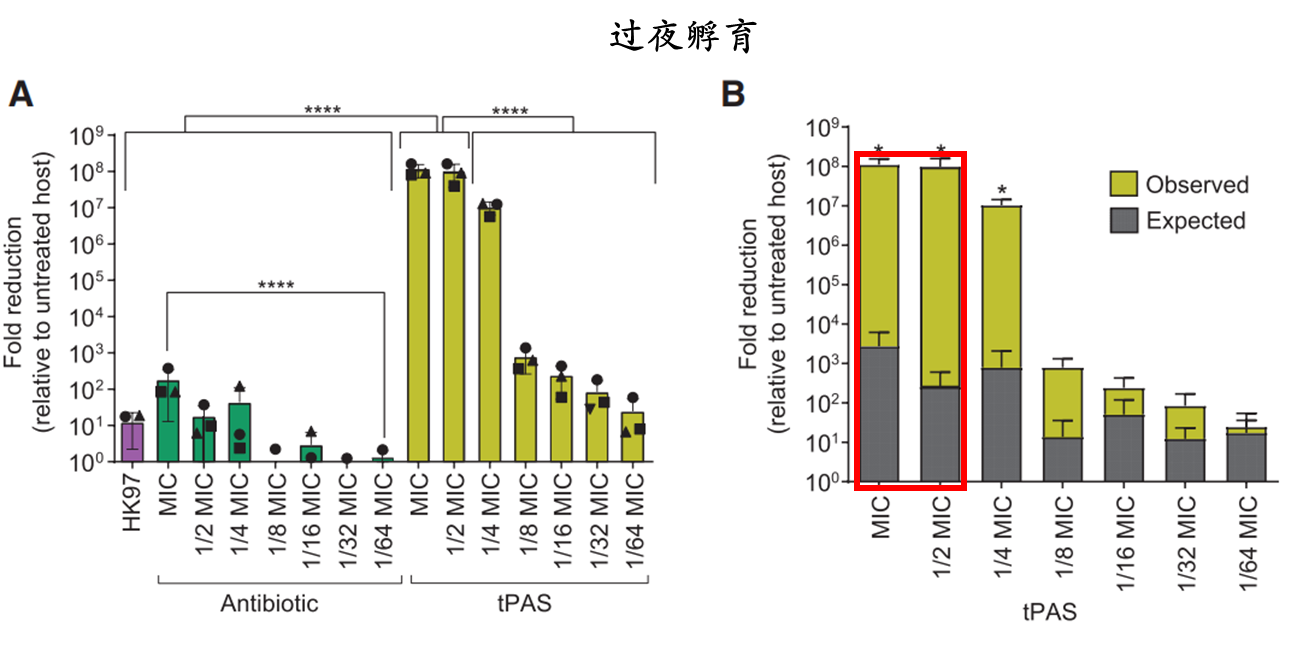
噬菌体单独条件下,过夜终点CFU仅降低了10倍,相比之下,在1/2CP-tPAS,细菌被根除与对照组相比,终点菌落的CFU减少了2.7*108。将观察到的数据与噬菌体和抗生素的独立效应的预期乘法进行比较,得到了噬菌体HK97与环丙沙星使用时产生强协同效应的最明确证据(图B)。
这种联合治疗可以增强抗生素或噬菌体的杀伤效果。
tPAS背后的机制是什么?
首先确定是否是传统PAS的已知机制:即抗生素存在时,与噬菌体产量增加有关,包括菌斑大小和噬菌体爆发量。
3. 温和噬菌体-抗生素协同作用(tPAS )不同于传统的PAS
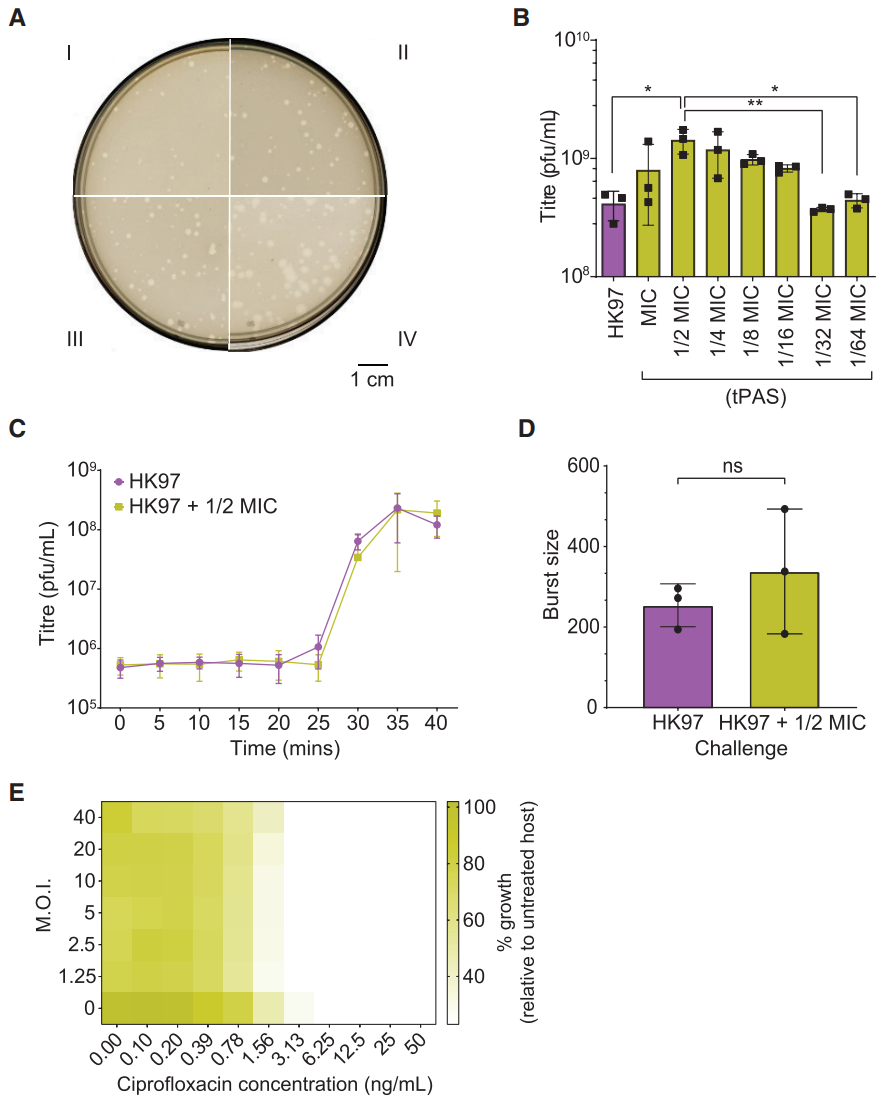
噬菌斑大小略有增加(图A);噬菌体滴度仅在½MIC时增加3倍,相比传统PAS增加量要小的多(图B),即tPAS协同作用机制与传统PAS作用机制不同,噬菌体数量的减少不是由更多的噬菌体驱动的;有无环丙沙星,噬菌体HK97的潜伏期不受影响(图C),即tPAS不受裂解时间变化的驱动;有无环丙沙星,噬菌体HK97的爆发量差异(4.1)远小于PAS(>10.5) (图D),即tPAS不受噬菌体爆发量的驱动;K12-recA突变体对单独的抗生素更敏感,与RecA的作用一致 (图E),然而,观察到的协同作用在K12-recA突变体中完全丧失,即SOS反应在tPAS中发挥关键作用,与传统PAS作用机制不同。
4. tPAS耗尽溶原菌株种群
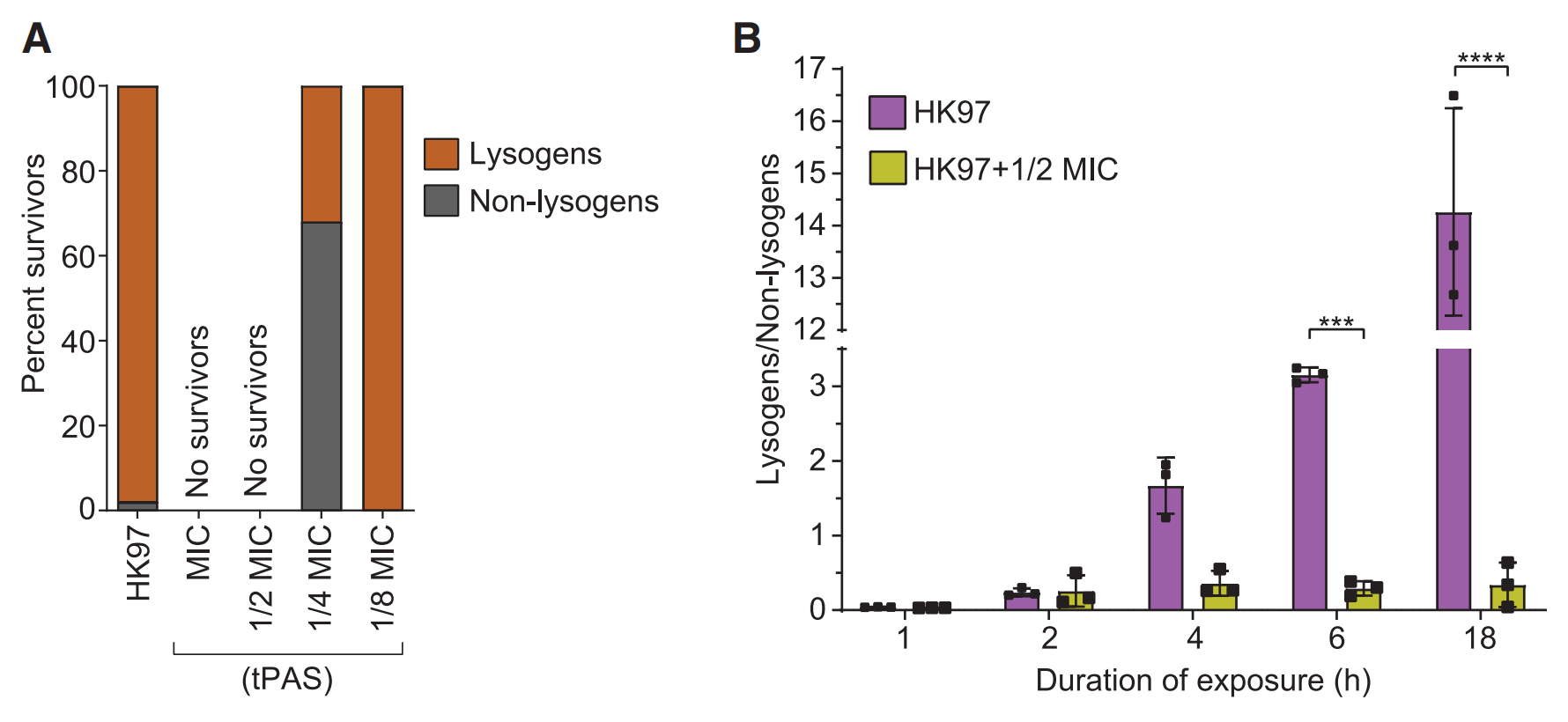
存活菌中溶原菌的百分比从没有抗生素的98%和1/8 MIC时的100% 降至1/2MIC时的32%,即随着抗生素浓度的增加,非溶原菌的比例增加;其原因是抗生素通过限制溶原种群的扩张,阻止了溶原菌群的形成。

KB和MIC测定曲线证实了溶原菌对环丙沙星的敏感性增加(图A, B);暴露在½MIC抗生素下的溶原菌的特征诱导生长曲线(图C),同时在½和¼MIC诱导4小时后HK97噬菌体滴度增加(图D)。表明为抗生素诱导噬菌体的结果。
即抗生素通过诱导溶原菌裂解,耗尽溶原菌株种群,进而达到tPAS协同消灭细菌的结果。
总结:
综上所述,在此系列研究中,作者阐明了温和噬菌体与抗生素协同作用的机制,这种协同作用与之前描述的烈性噬菌体不同,在这种机制中,抗生素不仅仅增加噬菌体的产量,而且通过RecA蛋白(细菌SOS反应的关键元素)起作用,即抗生素通过诱导细菌群落中溶原菌的裂解,耗尽溶原菌株种群,阻止了溶原菌的生存,进而达到tPAS协同消灭细菌的结果。研究的结果为温和噬菌体作为佐剂的应用提供了理论基础,这种协同作用可能为克服耐药性提供了一种有效的方案。
上一篇:食品中空肠弯曲菌的RAA-Exo-Probe和RAA-CRISPR/Cas12a快速检测方法的建立
下一篇:噬菌体有效降低小肠结肠炎耶尔森氏菌在食物和厨房用具上的污染量
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942




