致病性嗜水气单胞菌检测新方法:dRAA-CRISPR/Cas12a
嗜水气单胞菌是一种新型水源性和食源性病原体,对人类和温水鱼类具有致病性,严重威胁人类健康、食品安全和水产养殖。嗜水气单胞菌的致病性由多种毒力因子决定,有许多针对一个或多个毒力基因的方法来检测致病性嗜水气单胞菌,但均存在一些缺陷。为了缩短操作时间、简化流程、避免漏检、提高灵敏度和特异性等,基于dRAA分析和CRISPR/Cas12a系统,该研究开发了dRAA-CRISPR/Cas12a测定法,用于针对以aerA和hlyA基因为靶点的致病性嗜水气单胞菌进行检测。试验评估了dRAA-CRISPR/Cas12a的可行性、灵敏度、特异性和实用性,并对其检测条件进行优化。
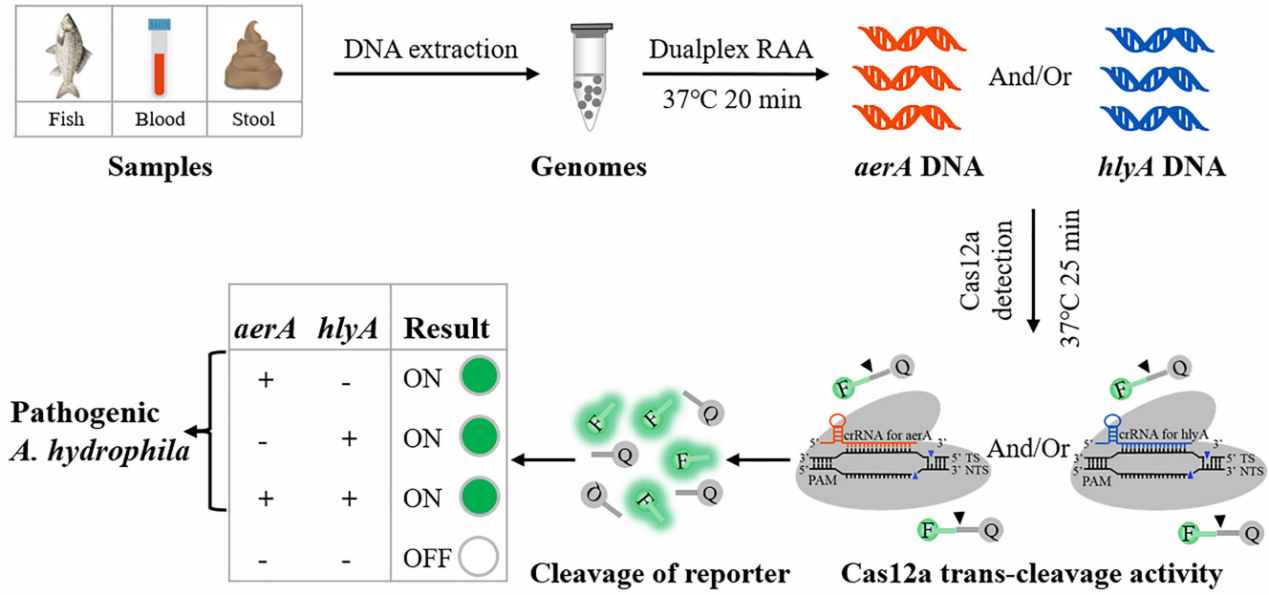
图1 检测致病性嗜水气单胞菌的dRAA-CRISPR/Cas12a方法示意图
dRAA-CRISPR/Cas12a检测嗜水气单胞菌的可行性验证
靶向aerA基因和hlyA基因的高扩增效率RAA最佳引物对的筛选
aerA和hlyA是嗜水气单胞菌的两个重要毒力基因,以其为靶点是检测致病性嗜水气单胞菌的可靠方法。为提高检测灵敏度,分别针对aerA基因和hlyA基因设计了5对引物对和4对引物对。
所有预测的产物条带均可明显区分(图2)。对于aerA基因,用引物AF5(5′-GCCATCAAGGTCAGCAATTGCGTACAAC-3′)/AR5(5’-CACTGGAACTTGCTTGCGCACCTTC-3′)获得的5号泳道条带相对强度最强;对于hlyA基因,用引物HF3(5′-CACTGTGGCCTACCTCAGCAACC-3′)/HR3(5’-CCTTGGTGTGTGTGACCTTGCTCACCTCAAAC-3’)获得的8号泳道条带相对强度最强;使用这两个引物对通过dRAA分析扩增aerA基因和hlyA 基因,在10号泳道上存在两个强度令人满意的预测条带。
因此,选择RAA引物组AF5/AR5和HF3/HR3作为dRAA反应的最佳引物,并使用AF5/AR3和HF3/HR3的扩增子分别设计aerA和hlyA的crRNA。
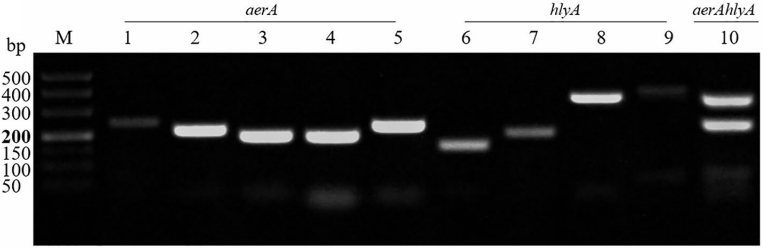
图2 以嗜水气单胞菌菌株提取的基因组DNA作为模板进行单和双复合RAA测定。泳道1-5.筛选靶向aerA基因的引物对。泳道6-9.筛选靶向hlyA基因的引物对。泳道10.使用最佳aerA和hlyA引物对进行dRAA测定的可行性。
研究设计的crRNA的有效性
设计了靶向aerA基因的ACR1和ACR2以及靶向hlyA基因的HCR1和HCR2.dRAA-CRISPR/Cas12a使用ACR1、ACR2、HCR1和HCR2作为crRNAmix,可以用于检测表达aerA和/或hylyA基因的致病嗜水气单胞菌(图3)。
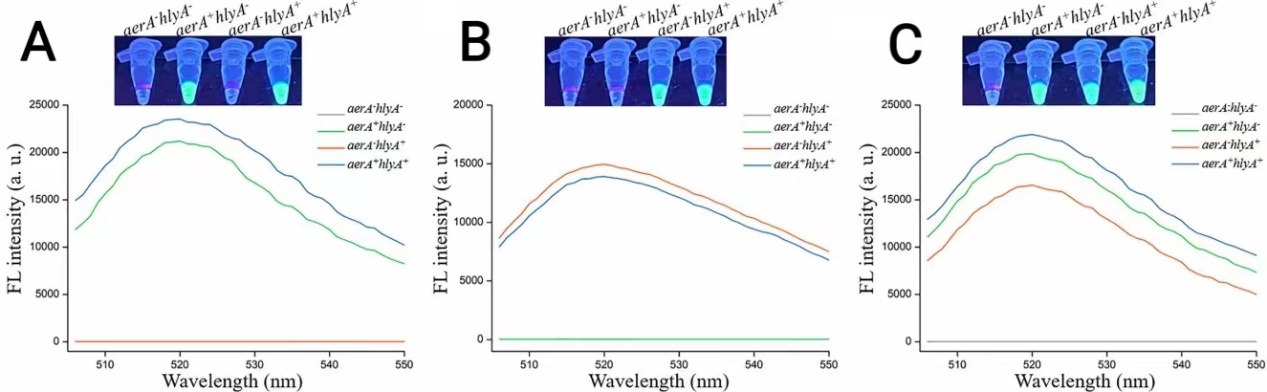
图3 使用ACR1和ACR2(A)、HCR1和HCR2(B)以及ACR1、ACR2、HCR1和HCR1(C)对dRAA-CRISPR/Cas12a测定进行可行性验证,以检测四种嗜水气单胞菌菌株。使用UV手电筒或多功能微孔板阅读器读取荧光信号。
dRAA-CRISPR/Cas12a测定条件的优化
Cas12a和ssDNA FQ的浓度和Cas12a裂解时间与基于CRISPR的检测方法的裂解效率、信号输出和反应速度有关。为了获得理想的反应性能,进行了dRAA-CRISPR/Cas12a分析。
采用嗜水气单胞菌(F)触发的荧光强度与H2O(F0)触发的的荧光强度之比来评估Cas12a和ssDNA FQ的反应浓度。F和F0均随Cas12a浓度的增加而增加,当Cas12a的浓度为600nm时,F/F0的比值达到最大值(图4A)。ssDNA FQ的最佳浓度为500nm(图4B)。使用优化浓度的Cas12a(600nm)和ssDNA-FQ(500nm)进一步探索Cas12a的裂解时间。在25min后F的增加达到一个平台,表明Cas12a的最适裂解时间为25min(图4C)。
因此,dRAA-CRISPR/Cas12a的反应条件如下:20min RAA反应,5μl 600nm Cas12a,5μl 400nm crRNAmix,10μl 500nm ssDNA FQ,25min Cas12a裂解,在随后的实验中,根据上述条件进行dRAA CRISPR/Case12a测定。
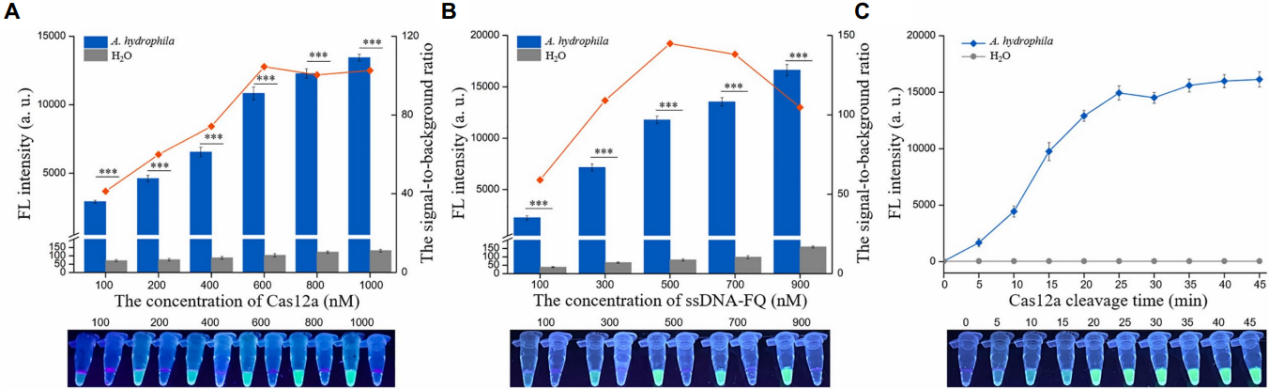
图4 使用AF5/AR5和HF3/HR3作为RAA引物组、aerA+ hlyA+ 嗜水气单胞菌基因组DNA(1 × 104 copies/μl)或H2O作为RAA模板,ACR1、ACR2、HCR1和HCR2作为crRNA混合物,以优化Cas12a(A)和ssDNA FQ(B)的浓度以及Cas12a的裂解时间(C)。使用紫外线手电筒或多功能微孔板阅读器读取结果。
dRAA-CRISPR/Cas12a检测嗜水气单胞菌的灵敏度
除阴性对照(H2O;图5)外,所有样品均检测到荧光信号,dRAA-CRISPR/Cas12a对表达aerA和/或hlyA基因的致病性嗜水气单胞菌显示出高灵敏度(2 copies)。每个嗜水菌菌株的dRAA-CRISPR/Ca12a分析检测限(LOD)与dPCR-CRISPR/Cas12a检测的LOD一致(图5B)。
然而,由于用于研究dRAA-CRISPR/Cas12a敏感性的样品是纯细菌,可能无法反映dRAA-CRISPR/Cas12a在检测含有大量杂质(可能会影响RAA分析的扩增效率)的临床和环境样品时的真实敏感性。
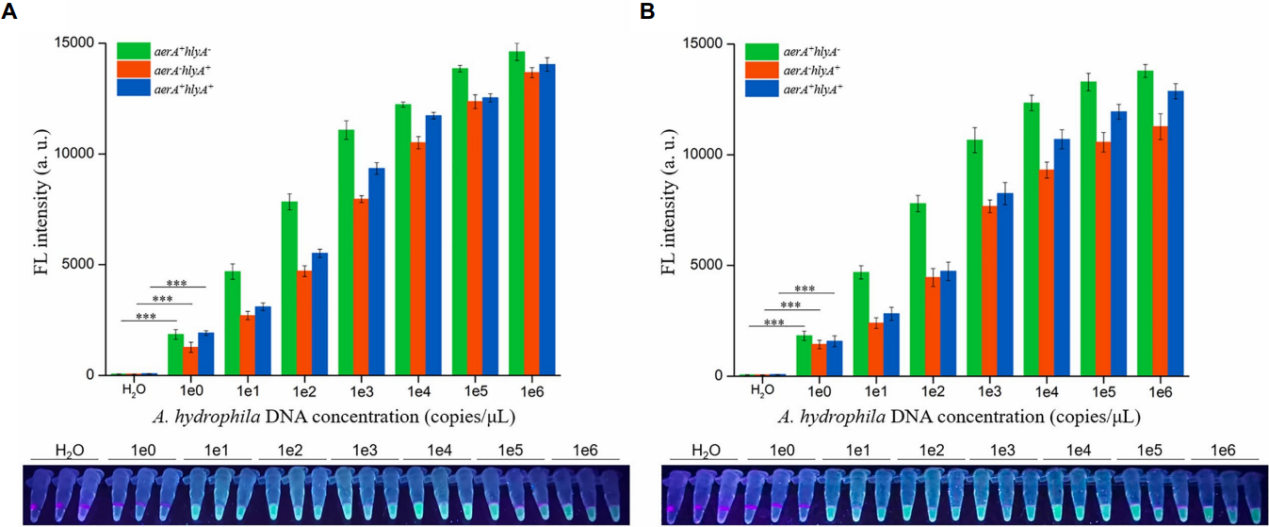
图5在检测致病性嗜水气单胞菌时,评估了dRAA-CRISPR/Cas12a(A)和dPCR-CRISPR/Cas12a(B)检测的敏感性。不同浓度(1×100-1×106 copies/μL)的嗜水气单胞菌基因组DNA作为检测模板,H2O作为阴性对照。使用紫外线手电筒或多功能微孔板阅读器读取结果。
dRAA-CRISPR/Cas12a检测嗜水气单胞菌的特异性
一株嗜水气单胞菌菌株(aerA+ hlyA-) 和其他12株非嗜水气单胞菌未产生荧光信号,而仅在表达aerA和/或hlyA基因的三株嗜水气单胞菌菌株中检测到荧光信号(图6)。因此,dRAA-CRISPR/Cas12a对表达aerA和/或hlyA基因的致病性嗜水蚤表现出高度特异性,没有交叉反应。
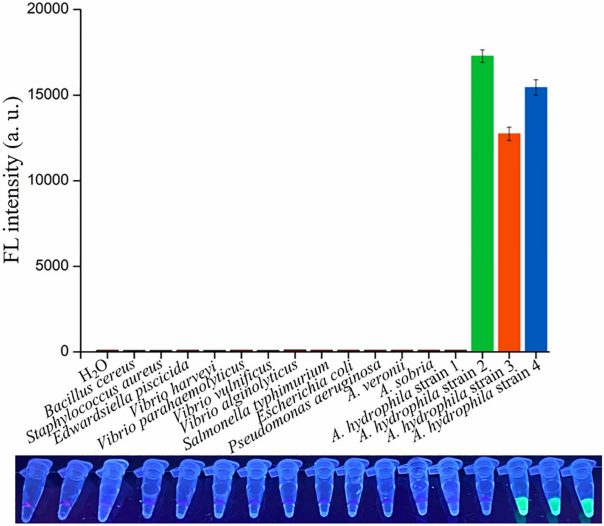
图6从4株嗜水气单胞菌菌株和12株其他水性和/或食源性致病菌菌株中提取的16个基因组DNA样品用作dRAA模板,H2O用作阴性对照。嗜水气单胞菌菌株1、2、3和4分别为aerA- hlyA+, aerA+ hlyA-, aerA- hlyA+和aerA+ hlyA+。
dRAA-CRISPR/Cas12a测定法检测加标样品的可行性评估
鱼和人体样本试验中,均只有加标样品才能产生荧光信号(图7A、D),与dPCR-CRISPR/Cas12a测定的结果一致(图7B、C)。因此, dRAA-CRISPR/Cas12a能够快速、准确地检测鱼类样品中的嗜水气单胞菌,还可用于检测由嗜水气单胞菌引起的临床败血症和胃肠炎。
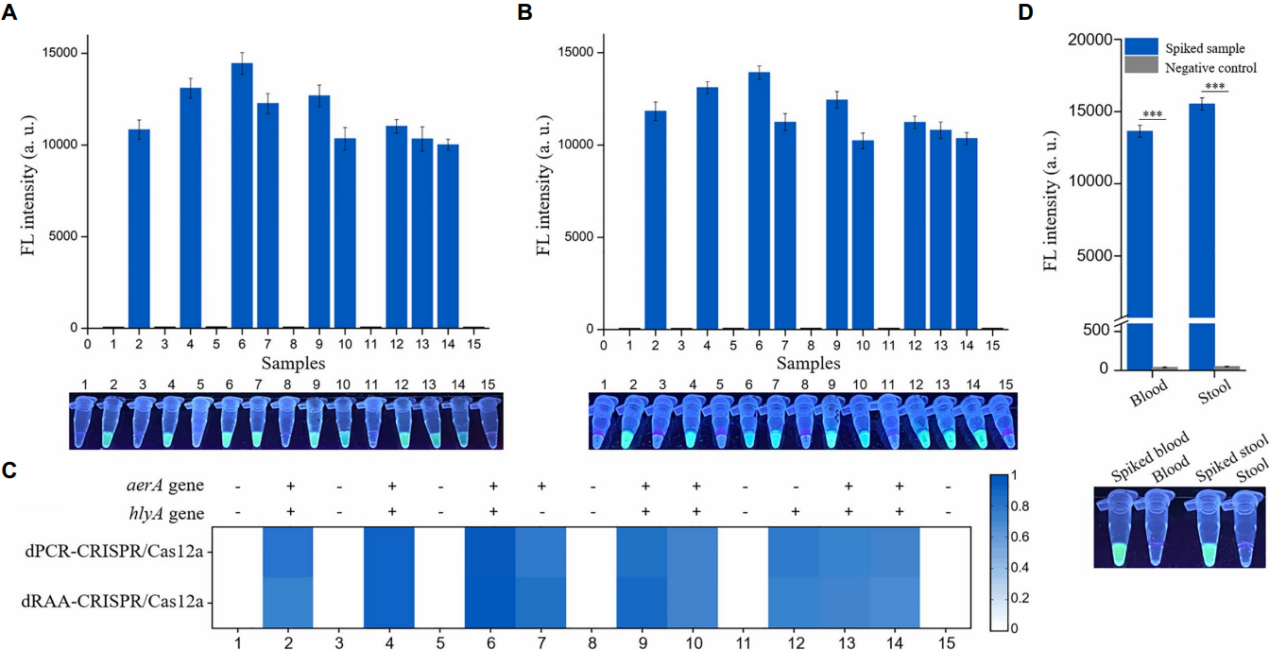
图7 对于鱼样品,从15只健康鲫鱼中取出肝脏,9个肝脏样品(20mg/样品)中加入1×103 CFU的嗜水气单胞菌,使用基于NaOH的方法从这15个肝脏样品中提取基因组DNA后进行dRAA-CRISPR/Cas12a(A)和dPCR-CRISPR/Cas12a(B)分析。(C)来自15条鲫鱼的嗜水气单胞菌的两种测定结果的热图。(D)对于人体样本,人类血液和粪便样品中加入1×103 CFU(aerA+ hlyA+)。正常血液和粪便样本作为阴性对照。使用UV手电筒或多功能微孔板阅读器读取荧光信号。
结论
在这项工作中,基于dRAA分析和CRISPR/Cas12a系统开发了一种新的方法,用于针对以aerA和hlyA基因为靶点的致病性嗜水气单胞菌进行检测,即dRAA-CRISPR/Cas12a。该方法无需复杂仪器,且灵敏度高,可快速准确检测(优化条件后约45分钟)嗜水气单胞菌,并对三种致病性嗜水气单胞菌(aerA+ hlyA-,aerA- hlyA+和aerA+ hlyA+)具有高特异性,进一步证实了该研究设计的crRNA和RAA引物集的有效性。此外,dRAA-CRISPR/Cas12a 方法在分析加标的人血、粪便和鱼类样品中表现出令人满意的实用性。这些结果表明,dRAA-CRISPR/Cas12a 是一种很有前途的诊断人类嗜水气单胞菌感染及食品和水产养殖业快速检测嗜水气单胞菌的方法。
参考文献: Lin Z, Lu J, Wu S, Lin X, Zheng L, Lou Y and Xiao X (2022) A novel detection method for the pathogenic Aeromonas hydrophila expressing aerA gene and/or hlyA gene based on dualplex RAA and CRISPR/Cas12a. Front. Microbiol. 13:973996. doi: 10.3389/fmicb.2022.973996
上一篇:基于微波加热的一步法快速合成DNA和RNA修饰金纳米颗粒
下一篇:特异性捕获铜绿假单胞菌以快速检测尿路感染中的抗菌素耐药性
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942




