羊肚菌多糖:非酒精性脂肪肝病治疗的新希望
羊肚菌多糖:非酒精性脂肪肝病治疗的新希望


非酒精性脂肪肝病(NAFLD)是全球范围内最常见的慢性肝病之一,其发病率逐年上升[1],严重威胁人类健康。当前 NAFLD 的发病机制尚未完全阐明,研究发现关键起因是脂质在肝细胞内的积累。近年来,AMPK(AMP激活蛋白激酶)和 Sirt1(沉默信息调节因子1)信号通路在调节脂质代谢和能量平衡中的作用引起了广泛关注。AMPK 和 Sirt1 通过相互激活,能够抑制脂肪生成并促进脂肪酸的β-氧化,从而减少肝细胞内的脂质积累[2,3]。
食用菌多糖因其多种潜在的药理活性而被广泛研究,尤其是在调节脂质代谢、抗炎和抗氧化方面[4,5]。羊肚菌(Morchella esculenta)是一种经济价值较高的食用菌,其多糖成分已被证明具有抗动脉粥样硬化的作用[6]。然而,关于羊肚菌多糖在 NAFLD 中的保护作用及其机制尚未有深入研究。最近,中国科学技术大学段亚军教授团队在《International Journal of Biological Macromolecules》上发表题为“Hepatoprotective effects of polysaccharide from Morchella esculenta are associated with activation of the AMPK/Sirt1 signaling pathway in mice with NAFLD”的研究论文,探讨了羊肚菌多糖( Morchella esculenta polysaccharide, MCP)在 NAFLD 中的潜在治疗作用及其分子机制[7]。

MCP 显著改善高脂饮食(HFD)诱导的肝脂肪变性
MCP 显著降低了 HFD 喂养小鼠的血清和肝脏中的甘油三酯(TG)、胆固醇(TC)和游离脂肪酸(FFA)水平,减少了肝脏中的脂质积累,并改善了肝脏的病理学特征(图1)。
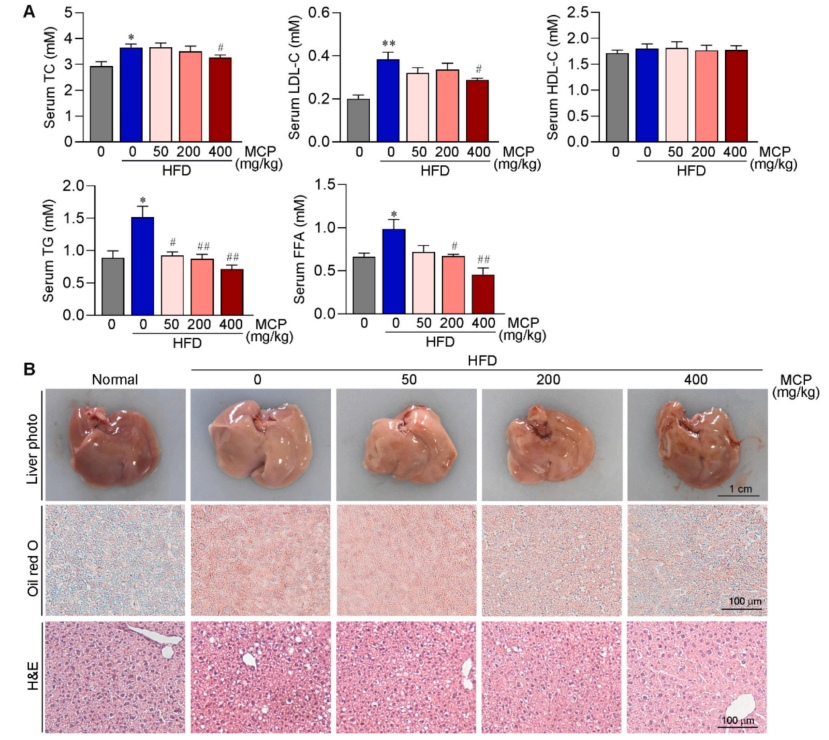
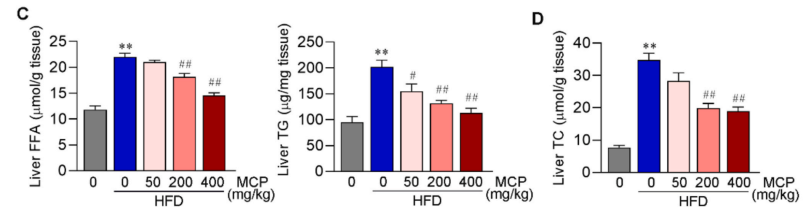
图1 MCP减弱HFD诱导的高脂血症和肝脏中的脂质积累
MCP 通过激活 AMPK/Sirt1 信号通路抑制脂质积累
MCP 显著抑制了脂肪生成相关基因(如 FASN 和 ACC1)的表达,并上调了脂肪酸β-氧化相关基因(如 PPARα)的表达(图2)。这些基因的作用与 AMPK/Sirt1 信号通路的激活密切相关。
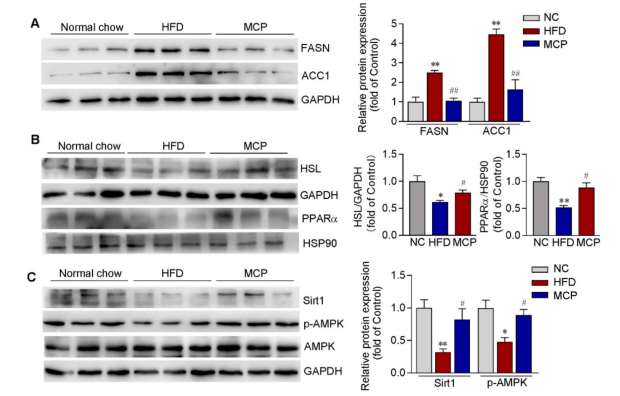
图2 MCP处理可激活AMPK/Sirt1通路
MCP 可以改善蛋氨酸胆碱缺乏饮食喂养(MCD) 诱导的非酒精性脂肪肝炎(NASH) 和肝纤维化
通过油红O染色、H&E染色和天狼星红染色评估肝脏脂肪变性、炎症和纤维化程度。MCP 显著降低了 MCD 喂养小鼠的肝脏炎症和纤维化程度,减少了氧化应激和肝细胞凋亡(图3,图4)。通过蛋白质印迹和qRT-PCR评估,在MCD饮食喂养的小鼠中,MCP治疗显著降低了纤维化标志物 α-平滑肌肌动蛋白 (α-SMA) 和I型胶原 α1 (CoL1a1) 表达,同时降低了血清促炎细胞因子如IL-6和TNF-α 的水平(图5)。
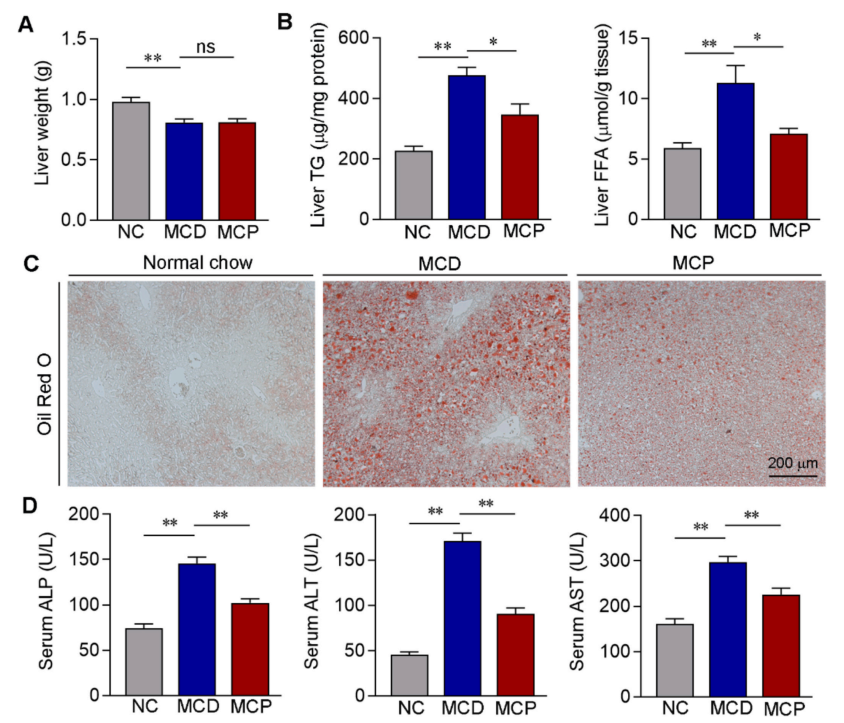
图3 MCP减轻MCD处理的小鼠的肝脏脂肪变性和损伤
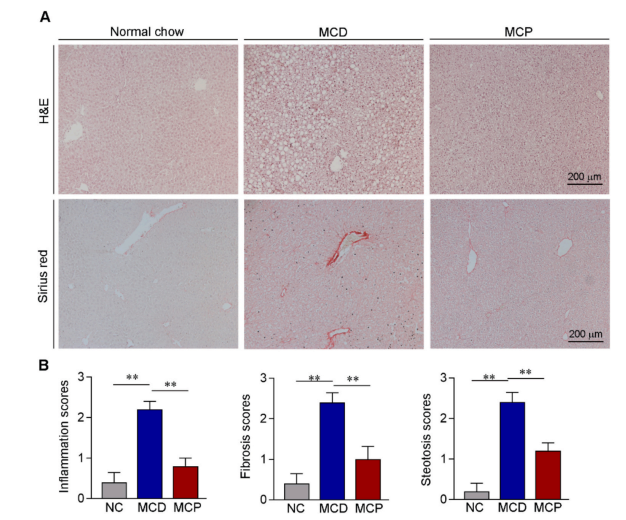
图4 MCP改善了MCD处理的小鼠的肝脏组织形态学
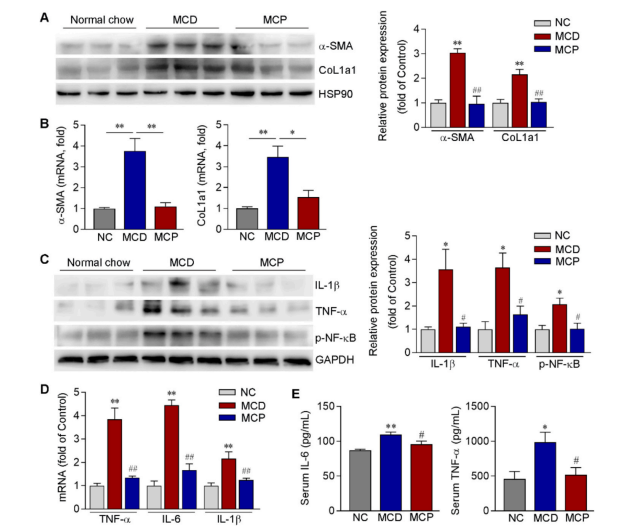
图5 MCP减轻MCD饮食诱导的小鼠纤维化和炎症
MCP抑制MCD诱导的氧化应激和细胞凋亡
DHE染色显示,MCP处理的MCD诱导的小鼠肝脏ROS水平,因抗氧化酶(如SOD1和SOD2)的表达增强而受到抑制。进一步通过TUNEL测定证实了MCP可以防止MCD诱导的肝细胞凋亡,同时通过抑制Caspase 3途径并上调Bcl-2表达,提高肝细胞存活率(图6)。
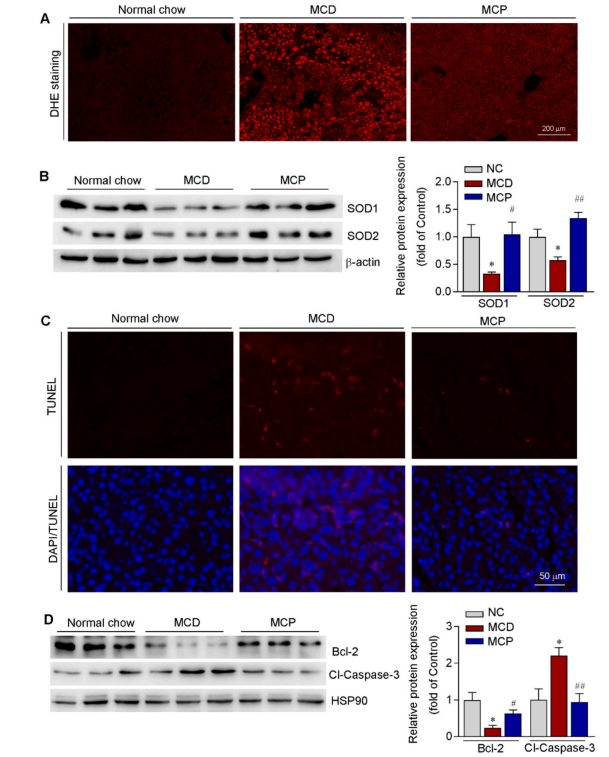
图6 MCP抑制饲喂MCD饮食的小鼠的肝脏氧化应激和肝细胞凋亡
MCP激活AMPK途径增强 β-氧化
为了阐明MCP改善脂质积累和肝损伤的原因,我们研究了PPARα 和AMPK/Sirt1蛋白通路在肝脏的表达情况。与对照组相比,MCD喂养的小鼠PPARα、Sirt1表达和AMPK活性降低,导致脂肪酸 β-氧化减少和TG储存增强。MCP治疗显著逆转了这一情况(图7)。
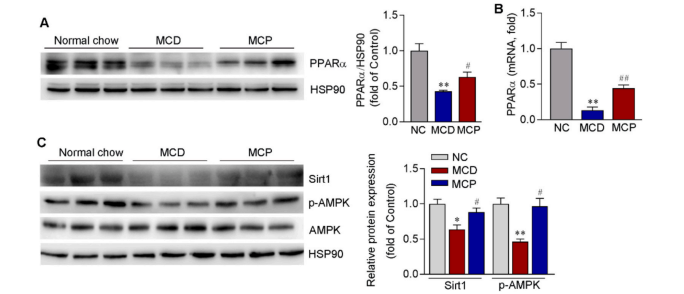
图7 MCP上调PPARα 参与FA β-氧化的表达并激活AMPK/Sirt1信号通路
MCP通过激活AMPK/ Sirt1信号抑制肝细胞脂质积累
在 AML12 肝细胞中,MCP 通过激活 AMPK/Sirt1 信号通路显著减少了脂质积累,而 AMPK 和 Sirt1 抑制剂则逆转了这一效应(图8)。
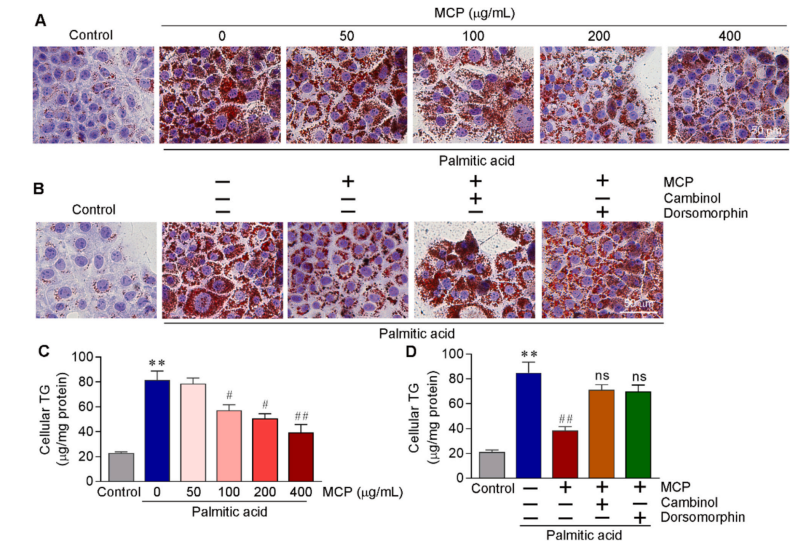
图8 MCP通过激活AMPK/Sirt1信号抑制AML12脂质积累
综上所述,本研究首次揭示了羊肚菌多糖(MCP)通过 AMPK/Sirt1 信号通路改善 NAFLD 的分子机制,具有重要的科学意义和应用价值,为 MCP 作为功能性食品或药物用于 NAFLD 的治疗提供了理论依据。然而,尽管 MCP 在动物模型中表现出显著的效果,但其在人体中的安全性和有效性仍需进一步验证。总的来说,这项研究为开发基于天然产物的 NAFLD 治疗策略提供了新的思路,也为羊肚菌多糖在功能性食品和药物中的应用开辟了新的方向。
参考文献
[1] Z.M. Younossi, A.B. Koenig, D. Abdelatif, Y. Fazel, L. Henry, M. Wymer, Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes, Hepatology 64 (2016) 73–84.
[2] C. Canto´, Z. Gerhart-Hines, J.N. Feige, M. Lagouge, L. Noriega, J.C. Milne, et al. AMPK regulates energy expenditure by modulating NAD+ metabolism and SIRT1 activity, Nature 458 (2009) 1056–1060.
[3] A. Purushotham, T.T. Schug, Q. Xu, S. Surapureddi, X. Guo, X. Li, Hepatocytespeciffcdeletion of SIRT1 alters fatty acid metabolism and results in hepatic steatosis and inffammation, Cell Metab. 9 (2009) 327–338.
[4] Q. Wang, F. Wang, Z. Xu, Z. Ding, Bioactive mushroom polysaccharides: a review on monosaccharide composition, biosynthesis and regulation, Molecules 22 (2017).
[5] J. Chen, J. Liu, C. Yan, C. Zhang, W. Pan, W. Zhang, et al. Sarcodon aspratus polysaccharides ameliorated obesity-induced metabolic disorders and modulated gut microbiota dysbiosis in mice fed a high-fat diet, Food Funct. 11 (2020) 2588–2602.
[6] D. Wang, Z. Yin, L. Ma, L. Han, Y. Chen, W. Pan, et al. Polysaccharide MCP extracted from Morchella esculenta reduces atherosclerosis in LDLR-deffcient mice, Food Funct. 12 (2021) 4842–4854.
[7] D. Wang, M. Zhang, Y. Zhang, Z. Yin, S. Zhang, Z. Zhao, Y. Duan. Hepatoprotective effects of polysaccharide from Morchella esculenta are associated with activation of the AMPK/Sirt1 signaling pathway in mice with NAFLD. Int J Biol Macromol. 28(2025)140444.
文献链接:https://doi.org/10.1016/j.ijbiomac.2025.140444
上一篇:解锁食用菌副产物的再利用潜能
下一篇:灵芝可治疗老人痴呆?我们有救啦!
1、凡本网所有原始/编译文章及图片、图表的版权均属微生物安全与健康网所有,未经授权,禁止转载,如需转载,请联系取得授权后转载。
2、凡本网未注明"信息来源:(微生物安全与健康网)"的信息,均来源于网络,转载的目的在于传递更多的信息,仅供网友学习参考使用并不代表本网同意观点和对真实性负责,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请速来函告知,我们将尽快处理。
3、转载请注明:文章转载自www.mbiosh.com
联系方式:020-87680942



