核心提示:菌落总数测定是用来判定食品被细菌污染的程度及卫生质量,它反映食品在生产过程中是否符合卫生要求,以便对被检样品做出适当的卫生学评价。菌落总数的多少在一定程度上标志着食品卫生质量的优劣。
一、菌落总数定义和卫生学意义
•菌落总数定义:指在一定条件下(如需氧情况、营养条件、pH、培养温度和时间等)每克(每毫升)检样所生长出来的菌落数
•卫生学意义:菌落总数测定是用来判定食品被细菌污染的程度及卫生质量,它反映食品在生产过程中是否符合卫生要求,以便对被检样品做出适当的卫生学评价。菌落总数的多少在一定程度上标志着食品卫生质量的优劣。
二、GB4789.2-2016菌落总数测定(平板法)
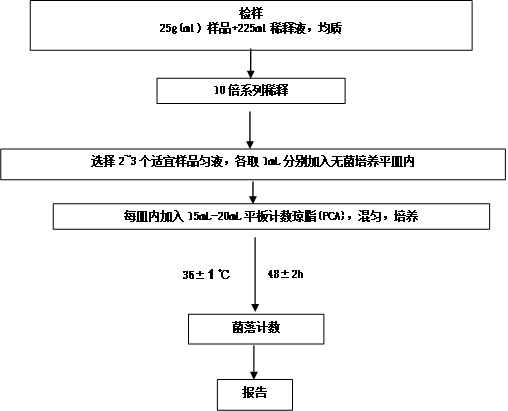
1. 菌落总数检验流程图

2. 结果计数
•可用肉眼观察,必要时用放大镜或菌落计数器,记录稀释倍数和相应的菌落数量。菌落计数以菌落形成单位(colony-formingunits,CFU)表示。
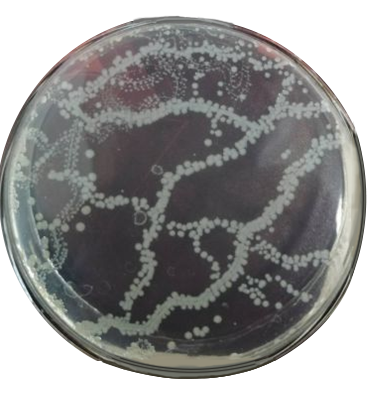
•选取菌落数在30CFU~300CFU之间、无蔓延菌落生长的平板计数菌落总数。低于30CFU的平板记录具体菌落数,大于300CFU的可记录为多不可计。每个稀释度的菌落数应采用两个平板的平均数。
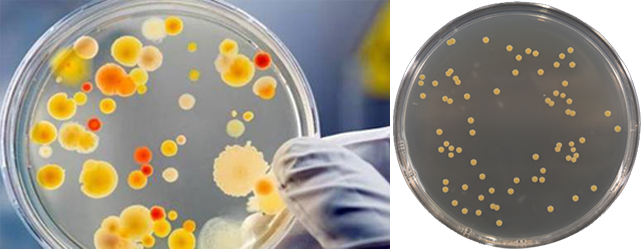
•其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀,即可计算半个平板后乘以2,代表一个平板菌落数。
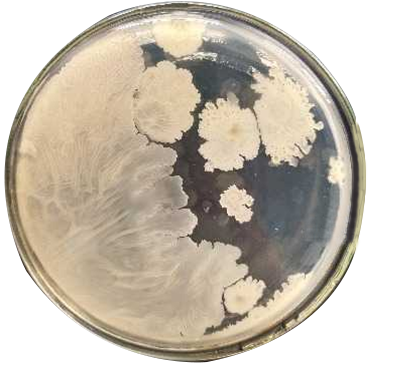
•当平板上出现菌落间无明显界线的链状生长势,则将每条单链作为一个菌落计数。
3. 结果计算
•若只有一个稀释度平板上的菌落数在30~300CFU之间,计算两个平板菌落数的平均值,再将平均值乘以相应稀释倍数,作为每g(mL)样品中菌落总数结果。
•若所有稀释度的平板上菌落数均大于300CFU,则对稀释度最高的平板进行计数,其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算。
•若所有稀释度的平板菌落数均小于30CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
•若所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算。
•若所有稀释度的平板菌落数均不在30CFU~300CFU之间,其中一部分小于30CFU或大于300CFU时,则以最接近30CFU或300CFU的平均菌落数乘以稀释倍数计算。
•若有两个连续稀释度的平板菌落数在适宜计数范围内时,按式(1)计算:

4. 结果报告
•菌落数小于100CFU时,按“四舍五入”原则修约,以整数报告。
•菌落数大于或等于100CFU时,第3位数字采用“四舍五入”原则修约后,取前2位数字,后面用0代替位数;也可用10的指数形式来表示,按“四舍五入”原则修约后,采用两位有效数字。
•若所有平板上为蔓延菌落而无法计数,则报告菌落蔓延。
•若空白对照上有菌落生长,则此次检测结果无效。
•称重取样以CFU/g为单位报告,体积取样以•CFU/mL为单位报告。
•注:菌落总数结果计算与报告方式实例见以下表格
编号 | 稀释倍数及菌落数 | |||||||
10-1 | 10-2 | 10-3 | 菌落总数 | 报告方式 | ||||
平皿1 | 平皿2 | 平皿1 | 平皿2 | 平皿1 | 平皿2 | (CFU/g或ml) | (CFU/g或ml) | |
1 | 0 | 0 | 0 | 0 | 0 | 0 | ﹤1×10 | ﹤10 |
2 | 24 | 26 | 5 | 7 | 0 | 0 | 250 | 250或2.5×102 |
3 | 多不可计 | 多不可计 | 150 | 160 | 15 | 20 | 15500 | 16000或1.6×104 |
4 | 多不可计 | 多不可计 | 236 | 245 | 35 | 33 | 24955 | 25000或2.5×104 |
5 | 多不可计 | 多不可计 | 236 | 245 | 25 | 33 | 24476 | 24000或2.4×104 |
6 | 多不可计 | 多不可计 | 多不可计 | 多不可计 | 320 | 330 | 325000 | 330000或3.3×105 |
7 | 多不可计 | 多不可计 | 310 | 320 | 28 | 26 | 27000 | 27000或2.7×104 |
8 | 多不可计 | 多不可计 | 295 | 325 | 22 | 20 | 29500 | 30000或3.0×104 |
9 | 菌落蔓延 | 菌落蔓延 | 菌落蔓延 | 菌落蔓延 | 菌落蔓延 | 菌落蔓延 | 菌落蔓延 | 菌落蔓延 |
三、质量控制和疑难解析
1. 质量控制
•实验室过程中,每批样品稀释液都要做空白对照。
•为了控制环境污染,每次检验过程中,于检验台上打开两块计数琼脂平板,并在检验环境中暴露不少于15分钟,将此平板与本批次样品同时进行培养,以掌握检验过程中是否存在来自检验环境的污染。
•定期使用大肠埃希氏菌ATCC25922、金黄色葡萄球菌ATCC6538和枯草芽孢杆菌ATCC6633或相应定量活菌参考品,在P2实验室或阳性对照实验室内,用适当的食品样品进行阳性实验验证,并进行记录,次验证实验至少每2个月进行1次。

Q-Strain定量质控菌株
2.疑难解析
1:为什么水产品与其他食品中菌落总数检测时所采用的培养条件不同?
水产品产自海水或淡水,其温度较低,因而在制定水产品的食品安全检验时选择了30±1℃进行培养,培养时间为72 ±3h。
2:当高稀释度平板上的菌落数反而比低稀释度平板上菌落数高时,如何处理?
首先结果不能直接记录报告。应针对此结果进行原因分析,并对剩余样品进行重复实验,如确认结果如此,则表示样品中可能有影响菌落计数结果的抑菌物质,应使用稀释、中和剂、过滤等方式去除样品中的抑菌物质再进行检测、报告。
3:当所有平板上都菌落密布时,结果如何报告?
不应报告多不可计,应在稀释度最高的两个平板上,分别任意取2cm2,计数其中的菌落数,计算每2cm2的平均菌落数,乘以平皿面积(如平皿直径为90mm,则乘以平皿面积63.6cm2),再乘以稀释倍数报告。
四、菌落总数测试片法
1. 原理:由轻便防水纸质材料做支撑,其上覆盖干燥培养基层(营养物质、凝固剂、选择抑制剂、显色剂)和透明隔水膜组成,经辐照灭菌。菌落总数检测片可用于食品、饮料等菌落总数计数,含有四氮唑指示剂菌落为红色。

HANDY PLATE 菌落总数测试片
2. 特点优势:
•菌落计数特别方便(容易判读),红色菌落,易于食品颗粒分开,无菌落重叠现象;
•菌落分布特别均匀;
•避免了培养基对细菌热损伤有关;
•菌落蔓延或半透明菌膜现象很少发生
•经济环保 无粉尘,体积小,重量轻,易储运 保质期长干制无水培养基,性质稳定,保质期更长
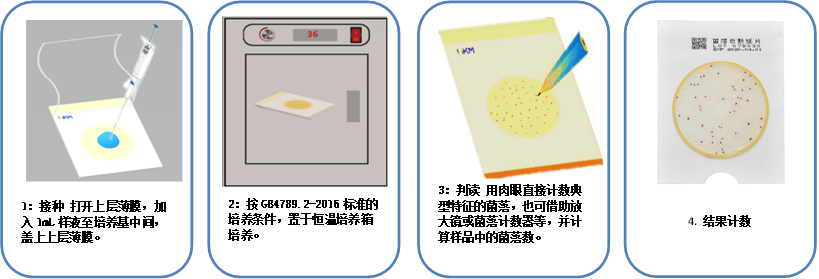
3. 操作注意事项
•接种时避免气泡产生。
•将测试片的透明面朝上置于培养箱内,堆叠片数不超过20片。
五、所需培养基试剂和质控菌株
用途 | 货号 | 名称 | 规格 |
样品稀释 | CP0630 | 生理盐水 | 盒(袋装)225 mL×10袋 |
CP0511A | 磷酸盐缓冲液(PBS) | 盒(瓶装)225 mL×6瓶 | |
CP0640 | 磷酸盐缓冲液(PBS) | 盒(袋装)225 mL×10袋 | |
022117 | 磷酸盐缓冲液(PBS) | 瓶(干粉)250 g | |
CP0310 | 生理盐水 | 盒(管装)9 mL×20支 | |
平板计数 | 022070 | 平板计数琼脂(PCA) | 瓶(干粉)250 g |
CP0830 | 平板计数琼脂平板(PCA) | 盒(平板)90 mm×20 | |
022070P1 | 平板计数琼脂(PCA) | 瓶(颗粒)250 g | |
HANDYPLATE微生物测试片 | HP001 | 菌落总数测试片 | 20片/包 |
Q-Strain定量质控菌株 | QS011A | 大肠埃希氏菌(ATCC25922) | 110-1100 CFU/瓶 |
QS011B | 大肠埃希氏菌(ATCC25922) | (0.6-2.0)×107 CFU/瓶 | |
QS008A | 金黄色葡萄球菌(ATCC6538) | 110-1100 CFU/瓶 | |
QS008B | 金黄色葡萄球菌(ATCC6538) | (0.6-2.0)×107 CFU/瓶 | |
QS004A | 枯草芽孢杆菌(CMCC(B) 63501) | 110-1100 CFU/瓶 | |
QS004B | 枯草芽孢杆菌(CMCC(B) 63501) | (0.6-2.0)×107 CFU/瓶 |





